
Propriedades, riscos e usos do hidróxido de bário (Ba (OH) 2)
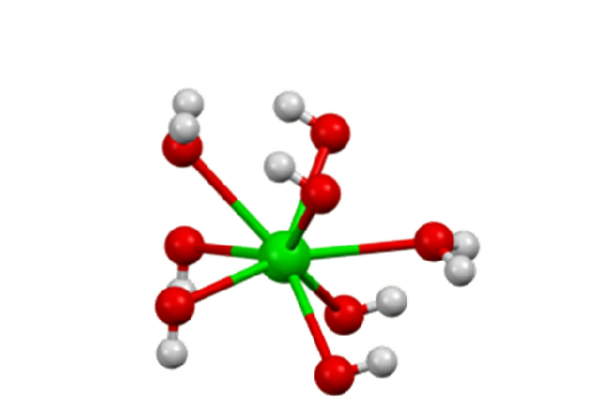
O hidróxido de bário é um composto químico com a fórmula Ba (OH)dois(HdoisOU)x. É uma base forte e pode estar na forma anidra, monohidratada ou octo-hidratada. A forma monohidratada, também chamada de água de barita, é a mais comum e usada comercialmente. A estrutura dos compostos anidros e monohidratos é apresentada na Figura 1.
O hidróxido de bário pode ser preparado dissolvendo o óxido de bário (BaO) em água: BaO + 9HdoisO → Ba (OH)dois8hdoisO. Ele se cristaliza como octahidrato, que se torna monohidrato quando aquecido ao ar. A 100 ° C sob vácuo, o monohidrato produzirá BaO e água.
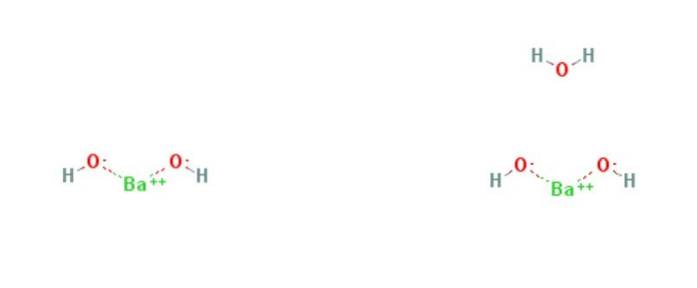
O monohidrato adota uma estrutura em camadas (figura 2). Os centros Badois+ eles adotam uma geometria octaédrica. Cada centro Badois+ é ligado por dois ligantes de água e seis ligantes de hidróxido, que são respectivamente duplas e triplas em ponte para os centros Badois+ vizinhos.
No octahidrato, os centros de Badois+ Os indivíduos são novamente oito coordenadas, mas não compartilham ligantes (hidróxido de bário, S.F.).
Índice do artigo
- 1 Propriedades do hidróxido de bário
- 2 Reatividade e perigos
- 2.1 Contato visual
- 2.2 Contato com a pele
- 2.3 Inalação
- 2.4 Ingestão
- 3 usos
- 3.1 1- Indústria
- 3.2 2- Laboratório
- 3.3 3- Catalisador na reação de Wittig-Horner
- 3.4 4- Outros usos
- 4 referências
Propriedades do hidróxido de bário
O hidróxido de bário são cristais octaédricos brancos ou transparentes. Inodoro e com sabor cáustico (National Center for Biotechnology Information., 2017). Sua aparência é mostrada na figura 3 (IndiaMART InterMESH Ltd., S.F.).

A forma anidra tem um peso molecular de 171,34 g / mol, uma densidade de 2,18 g / ml, um ponto de fusão de 407 ° C e um ponto de ebulição de 780 ° C (Royal Society of Chemistry, 2015).
A forma monohidratada tem um peso molecular de 189,355 g / mol, uma densidade de 3,743 g / ml e um ponto de fusão de 300 ° C (Royal Society of Chemistry, 2015).
A forma octo-hidratada tem um peso molecular de 315,46 g / mol, uma densidade de 2,18 g / ml e um ponto de fusão de 78 ° C (Royal Society of Chemistry, 2015).
O composto é ligeiramente solúvel em água e insolúvel em acetona. É uma base forte com um pKa de 0,15 e 0,64 para o primeiro e o segundo OH- respectivamente.
O hidróxido de bário reage de forma semelhante ao hidróxido de sódio (NaOH), mas é menos solúvel em água. Neutraliza ácidos exotermicamente para formar sais mais água. Pode reagir com alumínio e zinco para formar óxidos ou hidróxidos de metal e gerar gás hidrogênio.
Pode iniciar reações de polimerização em compostos orgânicos polimerizáveis, especialmente epóxidos.
Pode gerar gases inflamáveis e / ou tóxicos com sais de amônio, nitretos, compostos orgânicos halogenados, vários metais, peróxidos e hidroperóxidos. Misturas com gomas cloradas explodem quando aquecidas ou esmagadas (BARIUM HYDROXIDE MONOHYDRATE, 2016).
O hidróxido de bário se decompõe em óxido de bário quando aquecido a 800 ° C. A reação com o dióxido de carbono produz carbonato de bário. Sua solução aquosa altamente alcalina sofre reações de neutralização com ácidos. Assim, forma sulfato de bário e fosfato de bário com os ácidos sulfúrico e fosfórico, respectivamente..
HdoisSW4 + Ba (OH)dois Baso4 + 2hdoisOU
A reação com o sulfeto de hidrogênio produz sulfeto de bário. A precipitação de muitos sais de bário insolúveis ou menos solúveis pode resultar de uma reação de dupla substituição quando uma solução aquosa de hidróxido de bário é misturada com muitas soluções de outros sais de metal..
Misturar o hidróxido de bário hidratado sólido com cloreto de amônio sólido em um béquer produz uma reação endotérmica para produzir um líquido, com a evolução de amônia. A temperatura cai drasticamente para aproximadamente -20ºC (Royal Society of Chemistry, 2017).
Ba (OH)dois (s) + 2NH4Cl (s) → BaCldois (aq) + 2NH3 (g) + HdoisOU

O Ba (OH) 2 reage com o dióxido de carbono para produzir carbonato de bário. Isso é expresso pela seguinte reação química:
Ba (OH) 2 + CO2 → BaCO3 + H2O.
Reatividade e perigos
O hidróxido de bário é classificado como um composto estável e não combustível que reage rápida e exotermicamente com ácidos e é incompatível com dióxido de carbono e umidade. O composto é tóxico e, como base forte, é corrosivo.
A inalação, ingestão ou contato da pele com o material pode causar ferimentos graves ou morte. O contato com a substância fundida pode causar queimaduras graves na pele e nos olhos..
O contato com a pele deve ser evitado. Os efeitos do contato ou inalação podem ser retardados. O fogo pode produzir gases irritantes, corrosivos e / ou tóxicos. A água residual de controle de incêndio pode ser corrosiva e / ou tóxica e causar contaminação.
Contato visual
Se o composto entrar em contato com os olhos, as lentes de contato devem ser verificadas e removidas. Os olhos devem ser lavados imediatamente com água em abundância por pelo menos 15 minutos, com água fria.
Contato com a pele
Em caso de contato com a pele, a área afetada deve ser enxaguada imediatamente por pelo menos 15 minutos com bastante água ou um ácido fraco, por exemplo vinagre, enquanto se remove roupas e sapatos contaminados. Cubra a pele irritada com um emoliente.
Lave roupas e sapatos antes de reutilizá-los. Se o contato for severo, lave com sabonete desinfetante e cubra a pele contaminada com um creme antibacteriano..
Inalação
Em caso de inalação, a vítima deve ser removida para local fresco. Se não estiver respirando, é administrada respiração artificial. Se a respiração estiver difícil, dê oxigênio.
Ingestão
Se o composto for engolido, o vômito não deve ser induzido. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata.
Em todos os casos, deve-se obter atenção médica imediata (Folha de Dados de Segurança do Material, hidróxido de bário monohidratado, 2013).
Formulários
1- Indústria
Industrialmente, o hidróxido de bário é usado como precursor de outros compostos de bário. O monohidrato é usado para desidratar e remover o sulfato de vários produtos. Esta aplicação explora a solubilidade muito baixa do sulfato de bário. Esta aplicação industrial também se aplica a usos de laboratório.
O hidróxido de bário é usado como aditivo em termoplásticos (como resinas fenólicas), arranhões e estabilizadores de PVC para melhorar as propriedades do plástico. Este material é usado como aditivo de uso geral para lubrificantes e graxas..
Outras aplicações industriais de hidróxido de bário incluem fabricação de açúcar, fabricação de sabões, saponificação de gordura, fusão de silicato e síntese química de outros compostos de bário e compostos orgânicos (BARIUM HYDROXIDE, S.F.).
2- Laboratório
O hidróxido de bário é usado em química analítica para a titulação de ácidos fracos, particularmente ácidos orgânicos. Sua solução aquosa transparente é garantidamente livre de carbonato, ao contrário do hidróxido de sódio e do hidróxido de potássio, pois o carbonato de bário é insolúvel em água.
Isso permite o uso de indicadores como fenolftaleína ou timolftaleína (com alteração de cor alcalina) sem o risco de erros de titulação causados pela presença de íons carbonato, que são muito menos básicos (Mendham, Denney, Barnes, & Thomas, 2000).
O hidróxido de bário é ocasionalmente usado na síntese orgânica como uma base forte, por exemplo, para a hidrólise de ésteres e nitrilos:
O hidróxido de bário também é usado na descarboxilação de aminoácidos que liberam carbonato de bário no processo..
Também é utilizado na preparação de ciclopentanona, diacetona álcool e gama - lactona D - Gulonic.
3- Catalisador na reação de Wittig-Horner
A reação de Wittig-Horner, também conhecida como reação de Horner-Wadsworth-Emmons (ou reação HWE) é uma reação química usada em química orgânica para estabilizar carbânions de fosfonato com aldeídos (ou cetonas) para produzir predominantemente E-alcenos (trans).
A reação soncoquímica de Wittig-Horner é catalisada por hidróxido de bário ativado e é realizada em condições de interface sólido-líquido..
O processo soncoquímico ocorre à temperatura ambiente e com um peso de catalisador e tempo de reação mais baixos do que o processo térmico. Nessas condições, obtêm-se rendimentos semelhantes aos do processo térmico..
No trabalho de (J. V. Sinisterra, 1987) é analisada a influência no desempenho do tempo de sonicação, do peso do catalisador e do solvente. Devem ser adicionadas pequenas quantidades de água para que a reação ocorra.
A natureza do sítio ativo do catalisador atuando no processo é analisada. Um mecanismo ETC é proposto para o processo sonoquímico.
4- Outros usos
O hidróxido de bário tem outros usos. É usado para vários fins, como:
- A fabricação de álcali.
- Construção de vidro.
- Vulcanização de borracha sintética.
- Inibidores de corrosão.
- Como fluidos de perfuração, pesticidas e lubrificantes.
- Para o remédio da caldeira.
- Para refinar óleos vegetais e animais.
- Para pintura a fresco.
- Em amaciamento de água.
- Como ingrediente em remédios homeopáticos.
- Para limpar derramamentos de ácido.
- Também é usado na indústria de açúcar para preparar açúcar de beterraba.
- Materiais de construção.
- Produtos elétricos e eletrônicos.
- Revestimentos de piso.
Referências
- MONOIDRATO DE HIDRÓXIDO DE BÁRIO. (2016). Recuperado de cameochemicals: cameochemicals.noaa.gov.
- Hidróxido de bário. (S.F.). Recuperado de chemistrylearner: chemistrylearner.com.
- HIDROXIDO DE BÁRIO. (S.F.). Recuperado de chemicalland21: chemicalland21.com.
- IndiaMART InterMESH Ltd… (S.F.). Hidróxido de bário. Recuperado de indiamart: dir.indiamart.com.
- V. Sinisterra, A. F. (1987). Ba (OH) 2 como catalisador em reações orgânicas. 17. Reação de Wittig-Horner sólido-líquido interfacial sob condições sonoquímicas. The Journal of Organic Chemistry 52 (17), 3875-3879. researchgate.net.
- Folha de Dados de Segurança de Material Monohidrato de hidróxido de bário. (2013, 21 de maio). Recuperado de sciencelab: sciencelab.com/msds.
- Mendham, J., Denney, R. C., Barnes, J. D., & Thomas, M. J. (2000). Análise Química Quantitativa de Vogel (6ª ed.). Nova York: Prentice Hall.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 28 de março). PubChem Compound Database; CID = 16211219. Recuperado do PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Hidróxido de bário. Recuperado de chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Hidróxido de bário hidratado (1: 2: 1). Recuperado de chemspider: chemspider.com.
- Royal Society of Chemistry. (2015). Hidrato de dihidroxibário (1: 1). Recuperado de chemspider: chemspider.com.
- Royal Society of Chemistry. (2017). Reações endotérmicas sólido-sólido. Recuperado de: learn -ochemical: rsc.org.



Ainda sem comentários