
Causas da tensão superficial, exemplos, aplicações e experimentos
O tensão superficial É uma propriedade física que todos os líquidos apresentam e é caracterizada pela resistência que suas superfícies opõem a qualquer aumento de sua área. Isso equivale a dizer que a referida superfície buscará a menor área possível. Esse fenômeno entrelaça vários conceitos químicos, como coesão, adesão e forças intermoleculares..
A tensão superficial é responsável pela formação das curvaturas superficiais dos líquidos em recipientes tubulares (cilindros graduados, colunas, tubos de ensaio, etc.). Estes podem ser côncavos (curvos em forma de vale) ou convexos (curvos em forma de cúpula). Muitos fenômenos físicos podem ser explicados considerando as mudanças que a tensão superficial de um líquido sofre..

Um desses fenômenos é a tendência das moléculas líquidas a se aglomerarem em forma de gotas, quando repousam em superfícies que as repelem. Por exemplo, as gotas de água que vemos no topo das folhas não podem molhar devido à sua superfície cerosa e hidrofóbica..
No entanto, chega um momento em que a gravidade desempenha seu papel e a gota se derrama como uma coluna de água. Fenômeno semelhante ocorre em gotas esféricas de mercúrio quando derramado de um termômetro.
Por outro lado, a tensão superficial da água é a mais importante de todas, pois contribui e organiza o estado dos corpos microscópicos em meio aquoso, como as células e suas membranas lipídicas. Além disso, essa tensão é responsável pelo fato de a água evaporar lentamente, e alguns corpos mais densos do que podem flutuar em sua superfície..
Índice do artigo
- 1 Causas da tensão superficial
- 2 unidades
- 3 Tensão superficial da água
- 4 outros exemplos
- 4.1 Gases condensados
- 4.2 Líquidos não polares
- 4.3 Líquidos polares
- 5 aplicativos
- 5.1 Detergentes
- 5.2 Emulsões
- 6 experimentos simples
- 6.1 Experiência de clipe
- 6.2 Barco de papel
- 7 referências
Causas da tensão superficial
A explicação para o fenômeno da tensão superficial está no nível molecular. As moléculas de um líquido interagem entre si, de forma que são coesas em seus movimentos erráticos. Uma molécula interage com seus vizinhos próximos a ela e com aqueles acima ou abaixo dela.
No entanto, isso não acontece da mesma forma com as moléculas da superfície do líquido, que estão em contato com o ar (ou qualquer outro gás), ou com um sólido. Moléculas na superfície não podem coesão com as do ambiente externo.
Como resultado, eles não experimentam nenhuma força que os empurre para cima; apenas para baixo, de seus vizinhos no meio líquido. Para contrariar este desequilíbrio, as moléculas da superfície "se comprimem", pois só assim conseguem vencer a força que as empurra para baixo.
Uma superfície é então criada onde as moléculas estão em um arranjo mais tenso. Se uma partícula deseja penetrar no líquido, ela deve primeiro cruzar esta barreira molecular proporcional à tensão superficial do referido líquido. O mesmo se aplica a uma partícula que deseja escapar do fundo do líquido para o ambiente externo..
Portanto, sua superfície se comporta como se fosse um filme elástico que apresenta resistência à deformação..
Unidades
A tensão superficial é geralmente representada pelo símbolo γ e é expressa em unidades N / m, força vezes comprimento. Porém, na maioria das vezes sua unidade é o dyn / cm. Um pode ser convertido no outro pelo seguinte fator de conversão:
1 dyn / cm = 0,001 N / m
Tensão superficial da água
A água é o mais raro e surpreendente de todos os líquidos. Sua tensão superficial, bem como várias de suas propriedades, são excepcionalmente altas: 72 dín / cm à temperatura ambiente. Este valor pode aumentar até 75,64 dinas / cm, a uma temperatura de 0 ºC; ou diminuir para 58,85 ºC, a uma temperatura de 100 ºC.
Essas observações fazem sentido quando você considera que a barreira molecular se contrai ainda mais em temperaturas próximas ao congelamento ou "afrouxa" um pouco mais em torno do ponto de ebulição..
A água tem uma alta tensão superficial devido às ligações de hidrogênio. Se eles próprios são perceptíveis no líquido, são ainda mais perceptíveis na superfície. As moléculas de água estão fortemente emaranhadas, formando interações dipolo-dipolo do tipo H.doisOH OH.

Tal é a eficiência de suas interações que a barreira molecular aquosa pode até mesmo suportar alguns corpos antes que eles afundem. Nas seções de aplicativos e experimentos, este ponto será retomado.
Outros exemplos
Todos os líquidos apresentam tensões superficiais, em maior ou menor grau do que a água, sejam substâncias ou soluções puras. O quão fortes e tensas são as barreiras moleculares de suas superfícies dependerá diretamente de suas interações intermoleculares, bem como de fatores estruturais e energéticos..
Gases condensados
Por exemplo, as moléculas de gases no estado líquido interagem apenas umas com as outras por meio das forças dispersivas de Londres. Isso é consistente com o fato de que suas tensões superficiais têm valores baixos:
-Hélio líquido, 0,37 dyn / cm a -273 ºC
-Nitrogênio líquido, 8,85 dyn / cm a -196 ºC
-Oxigênio líquido, 13,2 dyn / cm a -182 ºC
A tensão superficial do oxigênio líquido é maior do que a do hélio porque suas moléculas têm uma massa maior..
Líquidos apolares
Espera-se que os líquidos não polares e orgânicos tenham tensões superficiais mais altas do que esses gases condensados. Entre alguns deles, temos o seguinte:
-Éter dietílico, 17 dyn / cm a 20 ° C
-n-Hexano, 18,40 dyn / cm a 20 ° C
-n-Octano, 21,80 dyn / cm a 20 ° C
-Tolueno, 27,73 dinas / cm a 25 ºC
Uma tendência semelhante é observada para esses líquidos: a tensão superficial aumenta à medida que suas massas moleculares aumentam. No entanto, o n-Octano deve, de acordo com isso, ter a maior tensão superficial e não tolueno. Aqui, as estruturas e geometrias moleculares entram em jogo.
As moléculas de tolueno, planas e em anel, têm interações mais eficazes do que as de n-octano. Portanto, a superfície do tolueno é "mais apertada" do que a superfície do n-octano.
Líquidos polares
Como existem interações dipolo-dipolo mais fortes entre as moléculas de um líquido polar, sua tendência é apresentar tensões superficiais mais elevadas. Mas nem sempre é assim. Entre alguns exemplos, temos:
-Ácido acético, 27,60 dyn / cm a 20 ° C
-Acetona, 23,70 dyn / cm a 20 ° C
-Sangue, 55,89 dyn / cm a 22 ° C
-Etanol, 22,27 dyn / cm a 20 ° C
-Glicerol, 63 dyn / cm a 20 ° C
-Cloreto de sódio fundido, 163 dinas / cm a 650 ° C
-Solução de NaCl 6 M, 82,55 dyn / cm a 20 ° C
Espera-se que o cloreto de sódio fundido tenha uma enorme tensão superficial: é um líquido iônico viscoso..
Por outro lado, o mercúrio é um dos líquidos com maior tensão superficial: 487 dinas / cm. Nele, sua superfície é composta por átomos de mercúrio fortemente coesos, muito mais do que as moléculas de água podem ser..
Formulários

A tensão superficial por si só não tem aplicações. No entanto, isso não significa que não esteja envolvida em vários fenômenos do cotidiano que, se não existissem, não ocorreriam..
Por exemplo, os mosquitos e outros insetos são capazes de andar na água. Isso ocorre porque suas pernas hidrofóbicas repelem água, enquanto sua baixa massa permite que eles permaneçam à tona na barreira molecular sem cair no fundo do rio, lago, lagoa, etc..
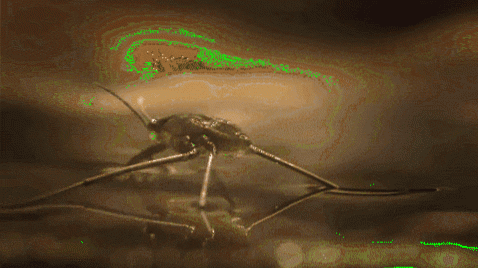
A tensão superficial também desempenha um papel na molhabilidade dos líquidos. Quanto maior for a tensão superficial, menor será a tendência de infiltrar-se nos poros ou rachaduras de um material. Além disso, eles não são líquidos muito úteis para limpar superfícies.
Detergentes
É aqui que os detergentes atuam, reduzindo a tensão superficial da água e ajudando-a a cobrir superfícies maiores; ao mesmo tempo em que melhora sua ação desengordurante. Ao diminuir sua tensão superficial, ele abre espaço para as moléculas de ar, com as quais forma bolhas..
Emulsões
Por outro lado, baixas tensões elevadas estão ligadas à estabilização das emulsões, que são muito importantes na formulação de uma gama diferente de produtos..
Experimentos simples

Por fim, serão citados alguns experimentos que podem ser realizados em qualquer espaço doméstico..
Experiência de clipe
Um clipe de metal é colocado em sua superfície em um copo de água fria. Como pode ser visto na imagem acima, o clipe permanecerá flutuando graças à tensão superficial da água. Mas se você adicionar um pouco de lava de barro ao vidro, a tensão superficial cairá drasticamente e o clipe de papel cederá repentinamente..
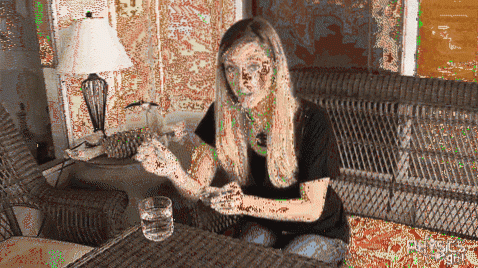
Barco de papel
Se na superfície tivermos um barquinho de papel ou um palete de madeira, e se a máquina de lavar louça ou detergente for adicionado à cabeça de um cotonete, então ocorrerá um fenômeno interessante: haverá uma repulsão que os propagará para as bordas do vidro. O barquinho de papel e o palete de madeira se afastarão do cotonete manchado de detergente.

Outra experiência semelhante e mais gráfica consiste em repetir a mesma operação, mas em um balde de água borrifado com pimenta-do-reino. As partículas de pimenta preta irão se afastar e a superfície mudará de pimenta coberta para cristalina, com a pimenta nas bordas.
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2020). Tensão superficial. Recuperado de: en.wikipedia.org
- USGS. (s.f.). Tensão superficial e água. Recuperado de: usgs.gov
- Jones, Andrew Zimmerman. (12 de fevereiro de 2020). Tensão superficial - definição e experimentos. Recuperado de: Thoughtco.com
- Susanna Laurén. (15 de novembro de 2017). Por que a tensão superficial é importante? Biolin Scientific. Recuperado de: blog.biolinscientific.com
- Rookie Parenting Science. (7 de novembro de 2019). O que é tensão superficial | Cool Science Experiment. Recuperado de: rookieparenting.com
- Jessica Munk. (2020). Experimentos de Tensão de Superfície. Estudar. Recuperado de: study.com
- A criança deve ver isso. (2020). Sete experimentos de tensão superficial - Physics Girl. Recuperado de: thekidshouldseethis.com



Ainda sem comentários