
Estrutura, propriedades, usos do sulfeto de cobre

O sulfeto de cobre é uma família de compostos inorgânicos cuja fórmula química geral é CuxSY. sim x é maior do que Y significa que o referido sulfeto é mais rico em cobre do que em enxofre; e se pelo contrário, x É menor que Y, então o enxofre é mais rico em enxofre do que cobre.
Numerosos minerais predominam na natureza, representando fontes naturais deste composto. Quase todos eles são mais ricos em cobre do que em enxofre, e sua composição é expressa e simplificada pela fórmula CuxS; aqui x pode até assumir valores fracionários, indicativos de um sólido não estequiométrico (Cu1,75S, por exemplo).

Embora o enxofre seja amarelo em seu estado elementar, seus compostos derivados parecem de cor escura; este também é o caso com o sulfureto de cobre. No entanto, o mineral covelita (imagem superior), que é composto principalmente de CuS, exibe brilho metálico e iridescência azulada..
Eles podem ser preparados a partir de diferentes fontes de cobre e enxofre, utilizando diferentes técnicas e variando os parâmetros de síntese. Assim, você pode obter nanopartículas de CuS com morfologias interessantes.
Índice do artigo
- 1 Estrutura do sulfeto de cobre
- 1.1 Links
- 1.2 Coordenações na covelita
- 1.3 Outros cristais
- 2 propriedades
- 2.1 Geral
- 2.2 Covelite
- 3 usos
- 3.1 Nanopartículas na medicina
- 3.2 Nanociência
- 4 referências
Estrutura do sulfeto de cobre
Links
Este composto tem a aparência de ser cristalino, então pode-se pensar imediatamente que é composto de íons Cu+ (cobre monovalente), Cudois+ (cobre divalente), Sdois- e, inclusive, Sdois- e Sdoisdois- (ânions dissulfeto), que interagem por meio de forças eletrostáticas ou ligações iônicas.
No entanto, há um leve caráter covalente entre Cu e S e, portanto, a ligação Cu-S não pode ser descartada. A partir desse raciocínio, a estrutura cristalina do CuS (e de todos os seus derivados sólidos) começa a diferir daquelas encontradas ou caracterizadas para outros compostos iônicos ou covalentes..
Em outras palavras, não podemos falar de íons puros, mas no meio de suas atrações (cátion-ânion) há uma ligeira sobreposição de seus orbitais externos (compartilhamento de elétrons).
Coordenações em la covelita
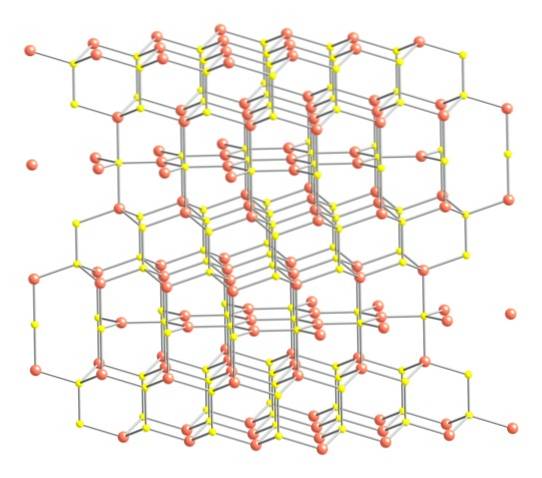
Posto isto, a estrutura cristalina da covelite é apresentada na imagem superior. É constituído por cristais hexagonais (definidos pelos parâmetros de suas células unitárias), onde os íons se unem e se orientam em diferentes coordenadas; estes são, com um número variado de vizinhos próximos.
Na imagem, os íons de cobre são representados por esferas rosa, enquanto os íons de enxofre são representados por esferas amarelas..
Focando a atenção primeiro nas esferas rosa, será notado que algumas são circundadas por três esferas amarelas (coordenação do plano trigonal) e outras por quatro (coordenação tetraédrica)..
O primeiro tipo de cobre, trigonal, pode ser identificado nos planos perpendiculares às faces hexagonais voltadas para o leitor, nas quais se encontram por sua vez o segundo tipo de carbono, o tetraédrico..
Voltando agora para as esferas amarelas, algumas têm cinco esferas rosa como vizinhas (coordenação da bipirâmide trigonal), e outras três e uma esfera amarela (novamente, coordenação tetraédrica); Neste último, observa-se o ânion dissulfeto, que pode ser visto abaixo e dentro da mesma estrutura da covelita:
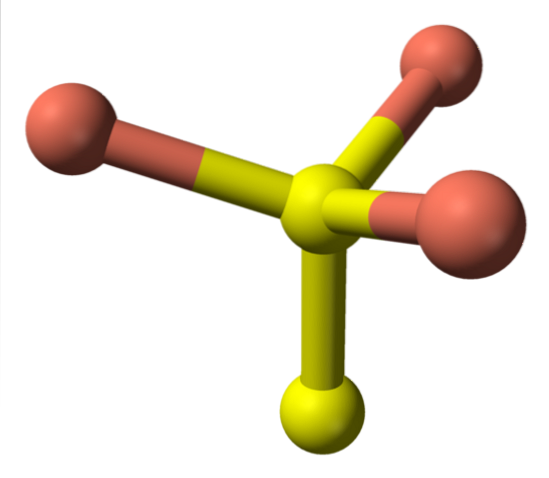
Fórmula alternativa
Existem então íons Cudois+, Cu+, Sdois- e Sdoisdois-. No entanto, estudos realizados com espectroscopia de fotoelétrons de raios-X (XPS), indicam que todo cobre é como cátions Cu.+; e, portanto, a fórmula inicial CuS, é expressa "melhor" como (Cu+)3(S2−) (Sdois)-.
Observe que a proporção Cu: S para a fórmula acima continua a ser 1 e, além disso, as cobranças são canceladas.
Outros cristais
Um sulfeto de cobre pode adotar cristais ortorrômbicos, como no polimorfo, γ-CudoisS, de calcocita; cúbico, como em outro polimorfo de calcocita, α-CudoisS; tetragonal, na anilita mineral, Cu1,75S; monoclínica, na djurleita, Cu1,96Sim entre outros.
Para cada cristal definido existe um mineral, e por sua vez, cada mineral possui suas próprias características e propriedades.
Propriedades
Em geral
As propriedades do sulfeto de cobre estão sujeitas à razão Cu: S de seus sólidos. Por exemplo, aqueles com ânions Sdoisdois- têm estruturas hexagonais e podem ser semicondutores ou condutores metálicos.
Se, por outro lado, o teor de enxofre consiste apenas em ânions Sdois-, sulfetos se comportam como semicondutores e também exibem condutividades iônicas em altas temperaturas. Isso ocorre porque seus íons começam a vibrar e se mover dentro dos cristais, transportando cargas elétricas..
Opticamente, embora também dependa de sua composição de cobre e enxofre, os sulfetos podem ou não absorver radiação na região do infravermelho do espectro eletromagnético. Essas propriedades ópticas e elétricas tornam os materiais potenciais a serem implementados em diferentes gamas de dispositivos..
Outra variável a se considerar, além da razão Cu: S, é o tamanho dos cristais. Não é apenas que existem mais sulfuretos de cobre “enxofre” ou “acobreados”, mas as dimensões de seus cristais conferem um efeito impreciso sobre suas propriedades; Assim, os cientistas estão ansiosos para estudar e buscar aplicações para nanopartículas de Cu.xSY.
Covelite
Cada sulfeto mineral ou de cobre tem propriedades exclusivas. Porém, de todas elas, a covelite é a mais interessante do ponto de vista estrutural e estético (pela sua iridescência e tons de azul). Portanto, algumas de suas propriedades são mencionadas a seguir.
Massa molar
95,611 g / mol.
Densidade
4,76 g / mL.
Ponto de fusão
500 ° C; mas quebra.
Solubilidade em água
3,3 10-5 g / 100 mL a 18ºC.
Formulários
Nanopartículas na medicina
Não apenas o tamanho das partículas varia até atingirem dimensões nanométricas, mas suas morfologias também podem variar muito. Assim, o sulfeto de cobre pode formar nanoesferas, hastes, placas, filmes finos, gaiolas, cabos ou tubos..
Essas partículas e suas morfologias atraentes adquirem aplicações individuais em diferentes campos da medicina..
Por exemplo, nanocages ou esferas vazias podem servir como transportadores de drogas dentro do corpo. Nanoesferas têm sido utilizadas, apoiadas por eletrodos de vidro de carbono e nanotubos de carbono, para funcionar como detectores de glicose; bem como seus agregados são sensíveis à detecção de biomoléculas como o DNA.
Os nanotubos CuS superam as nanoesferas na detecção de glicose. Além dessas biomoléculas, os imunossensores foram projetados a partir de filmes finos de CuS e certos suportes para a detecção de patógenos..
Nanocristais e agregados amorfos de CuS podem até causar apoptose de células cancerosas, sem causar danos às células saudáveis.
Nanociência
Na subseção anterior foi dito que suas nanopartículas fizeram parte de biossensores e eletrodos. Além de tais usos, cientistas e técnicos também aproveitaram suas propriedades para projetar células solares, capacitores, baterias de lítio e catalisadores para reações orgânicas muito específicas; Elementos indispensáveis em nanociência.
Também vale ressaltar que quando suportado em carvão ativado, o conjunto NpCuS-CA (CA: Carvão Ativado, e Np: Nanopartículas) provou servir como removedor de corantes prejudiciais ao homem e, portanto, funciona como purificador de fontes de água absorvendo moléculas indesejadas.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Sulfeto de cobre. Recuperado de: en.wikipedia.org
- Ivan Grozdanov e Metodija Najdoski. (novecentos e noventa e cinco). Propriedades Óticas e Elétricas de Filmes de Sulfeto de Cobre de Composição Variável. Journal of Solid State Chemistry Volume 114, Issue 2, 1 de fevereiro de 1995, Pages 469-475. doi.org/10.1006/jssc.1995.1070
- Centro Nacional de Informações sobre Biotecnologia. (2019). Sulfeto de cobre (CuS). Banco de dados PubChem. CID = 14831. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade e Nandipha L. Botha. (2017). Síntese, propriedades ópticas e estruturais
- of Copper Sulfide Nanocrystals from Single Molecule Precursors. Departamento de Química, Universidade de Fort Hare, Private Bag X1314, Alice 5700, África do Sul. Nanomateriais, 7, 32.
- Colaboração: Autores e editores dos volumes III / 17E-17F-41C (s.f.). Sulfuretos de cobre (Cu2S, Cu (2-x) S) estrutura cristalina, parâmetros de rede. Em: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein- Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlim, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Korean J. Chem. Eng. (2018). Aplicação de nanopartículas de sulfeto de cobre com carvão ativado para adsorção simultânea de corantes ternários: Metodologia de superfície de resposta. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F., & Cai, W. (2014). Síntese e aplicações biomédicas de nanopartículas de sulfeto de cobre: dos sensores à teranóstica. Small (Weinheim an der Bergstrasse, Alemanha), 10 (4), 631-645. doi: 10.1002 / smll.201301174


Ainda sem comentários