
Estrutura, propriedades, usos e riscos do ciclopropano (C3H6)

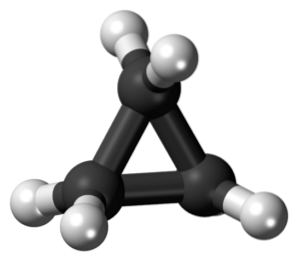
O ciclopropano é uma molécula cíclica que tem a fórmula molecular C3H6, e consistindo em três átomos de carbono ligados entre si na forma de um anel. Na química, existe uma família de hidrocarbonetos saturados que possuem um esqueleto feito de átomos de carbono unidos por ligações simples na forma de um anel..
Esta família consiste em um número variado de moléculas (que diferem pelo comprimento de sua cadeia de carbono principal), e são conhecidas por terem pontos de fusão e ebulição mais altos do que as de cadeias altas, bem como uma reatividade maior do que essas..
O ciclopropano foi descoberto em 1881 por um químico austríaco chamado August Freund, que estava determinado a saber qual era o elemento tóxico do etileno e que chegou a pensar que era o mesmo ciclopropano.
Mesmo assim, foi somente na década de 1930 que começou a ser produzido em nível industrial, quando descobriram seus usos como anestésico, pois antes dessa época não o encontravam atrativos comerciais..
Índice do artigo
- 1 Estrutura química
- 2 propriedades
- 2.1 Ponto de ebulição
- 2.2 Ponto de fusão
- 2.3 Densidade
- 2.4 Reatividade
- 3 usos
- 4 riscos
- 5 referências
Estrutura química
Ciclopropano, de fórmula molecular C3H6, É composto por três pequenos átomos de carbono que se unem em uma configuração tal que um anel é formado, deixando uma simetria molecular de D3h em cada carbono na cadeia.
A estrutura desta molécula exige que os ângulos de ligação que se formam sejam cerca de 60º, muito menos que os 109,5º que se observam entre os átomos híbridos sp.3, que é um ângulo mais estável termodinamicamente.
Isso faz com que o anel sofra uma tensão estrutural mais significativa do que outras estruturas deste tipo, além de uma tensão de torção natural que possui devido à conformação eclipsada de seus átomos de hidrogênio..
Por esse mesmo motivo, as ligações que se formam entre os átomos de carbono dessa molécula são consideravelmente mais fracas do que nos alcanos comuns..
De forma peculiar e ao contrário de outras ligações onde a proximidade entre duas moléculas simboliza maior energia de ligação, as ligações entre os carbonos desta molécula têm a particularidade de terem um comprimento menor que os outros alcanos (devido à sua geometria), e ao mesmo tempo vez que eles são mais fracos do que as uniões entre aqueles.
Além disso, o ciclopropano possui a estabilidade por deslocalização cíclica dos seis elétrons nas ligações carbono-carbono, sendo ligeiramente mais instável do que o ciclobutano e consideravelmente mais do que o ciclohexano..
Propriedades
Ponto de ebulição
Comparado com os outros cicloalcanos mais comuns, o ciclopropano tem o ponto de ebulição mais baixo entre esses tipos de moléculas, voltatilizando a 33 graus abaixo de zero (nenhum outro cicloalcanos volatiliza em temperaturas abaixo de zero).
Por outro lado, em comparação com o propano linear, o ciclopropano tem um ponto de ebulição superior: volatiliza-se a 42 ° C abaixo de zero, ligeiramente inferior ao de seu primo cicloalcano..
Ponto de fusão
O ponto de fusão do ciclopropano é inferior ao de outros cicloalcanos, fundindo a uma temperatura de 128 ºC inferior a zero. Mesmo assim, não é o único cicloalcano que funde a uma temperatura abaixo de zero, e esse fenômeno também pode ser observado no ciclobutano, ciclopentano e cicloheptano..
Portanto, no caso do propano linear, ele derrete a uma temperatura inferior a 187 ° C abaixo de zero..
Densidade
O ciclopropano tem a maior densidade entre os cicloalcanos, sendo mais de duas vezes maior do que o mais denso cicloalcano comum (1,879 g / l para o ciclopropano, superando o ciclodecano com 0,871).
Uma densidade mais alta também é observada no ciclopropano do que no propano linear. A diferença nos pontos de ebulição e fusão entre alcanos lineares e cicloalcanos se deve às forças de London mais altas, que são aumentadas pelo formato do anel que permite uma maior área de contato entre os átomos internos..
Reatividade
A reatividade da molécula de ciclopropano é diretamente afetada pela fraqueza de suas ligações, aumentando consideravelmente em comparação com outros cicloalcanos devido ao efeito da tensão exercida sobre essas ligações..
Graças a isso, o ciclopropano pode ser separado mais facilmente e pode se comportar como um alceno em certas reações. Na verdade, a extrema reatividade das misturas de ciclopropano-oxigênio pode causar risco de explosão..
Formulários
O uso comercial do ciclopropano por excelência é como agente anestésico, estudando esta propriedade pela primeira vez em 1929.
O ciclopropano é um agente anestésico poderoso e de ação rápida, que não irrita as vias aéreas nem deixa cheiros ruins. Foi usado por várias décadas junto com o oxigênio para adormecer os pacientes durante a cirurgia, mas efeitos colaterais indesejados começaram a ser observados, representados como "choque de ciclopropano"..
Junto com os fatores de custo e alta inflamabilidade, passou por um processo de descarte e substituição por outros agentes anestésicos mais seguros..
Embora tenha continuado a fazer parte dos compostos usados na indução anestésica, hoje não faz parte dos agentes usados em aplicações médicas..
Riscos
- O ciclopropano é um gás altamente inflamável, que produz gases tóxicos ao entrar em contato com uma chama. Além disso, pode reagir com agentes oxidantes como percloratos, peróxidos, permanganatos, nitratos e halogênios, causando incêndios e / ou explosões..
- Níveis elevados de ciclopropano podem causar dores de cabeça, tonturas, náuseas, perda de coordenação, sensação de desmaio e / ou vertigens..
- Também pode causar irregularidades do ritmo cardíaco ou arritmia, dificuldades respiratórias, coma e até morte..
- O ciclopropano liquefeito pode causar queimaduras na pele devido à sua temperatura consideravelmente abaixo de zero.
- Por ser um gás em condições ambientais, esse composto pode entrar facilmente no corpo pelo ar e também reduz o nível de oxigênio do ar..
Referências
- Britannica, E. (s.f.). Ciclopropano. Obtido em britannica.com
- Química, O. (s.f.). Síntese de ciclopropano. Recuperado de organic-chemistry.org
- ChemSpider. (s.f.). Ciclopropano. Obtido em chemspider.com
- Wagnières, O. (s.f.). Produtos naturais contendo ciclopropano. Recuperado de lspn.epfl.ch
- Wikipedia. (s.f.). Ciclopropano. Obtido em en.wikipedia.org


Ainda sem comentários