
Estrutura, propriedades, riscos e usos do sulfato férrico

O sulfato férrico, sulfato de ferro (III), O vitríolo de Marte ou caparrosa marciana, é um composto inorgânico de fórmula Fedois(SO4)3. Cada átomo de ferro tem três ligações iônicas com sulfato.
O sulfato férrico é encontrado em uma grande variedade de minerais, principalmente nos minerais pirita e marcassita, onde o sulfato ferroso está ligado ao óxido ferroso (Fe0)..
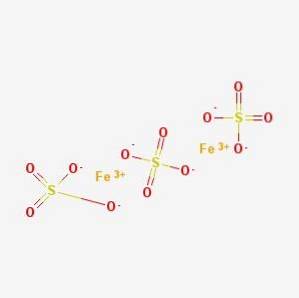
Outros minerais como coquimbita, kornelita e lausenita são fontes de sulfato férrico nona, hepta e pentahidrato. Por outro lado, pode ser encontrado em minerais como Mikasita, onde se mistura com o alumínio (Fórmula de sulfato férrico, 2005-2017).
O sulfato férrico é extraído principalmente da natureza, mas também pode ser preparado por evaporação de óxido férrico e ácido sulfúrico. É geralmente preparado pelo tratamento de sulfato ferroso e um agente oxidante com ácido sulfúrico a temperaturas elevadas como segue:
2FeSO4 + HdoisSW4 + HdoisOUdois → Faithdois(SW4)3 + 2hdoisOU
As soluções de sulfato férrico são preparadas pela injeção de cloro gasoso em uma solução de sulfato ferroso.
Em solução aquosa Fedois (SW4)3 dissocia-se em íons de Fe3+ (aq) e SO4dois- (aq). Os íons sulfato serão solvatados por ligações de hidrogênio com água e os íons ferro formarão o complexo hexa-hidratado (III), [Fe (H2O) 6]3+ (O que acontece com o sulfato de ferro (III) (sulfato férrico) em solução aquosa?, 2015).
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 3 usos
- 4 referências
Propriedades físicas e químicas
O sulfato férrico é um sólido higroscópico cuja aparência e aroma podem variar dependendo da quantidade de água contida no sal..
As formas mais comuns em que o sulfato de ferro (III) é encontrado na natureza são a tenepes hidratada e nenhuma. Nesse caso, os cristais deste composto podem ser de cor amarela. Quando está na forma anidra, apresenta cor cinza (Sulfato férrico, 2016).

As moléculas de sulfato férrico formam cristais rômbicos ou romboédricos. Sua forma anidra tem um peso molecular de 399,858 g / mol, sua penta hidratada e nenhuma forma têm um peso molecular de 489,960 g / mol e 562.000 g / mol, respectivamente (Royal Society of Chemistry, 2015).
Sua densidade é de 3,097 g / ml (anidro) e seu ponto de fusão é 480º C (anidro) e 175º C (não hidratado). É ligeiramente solúvel em água e álcool, enquanto muito ligeiramente solúvel em acetona e acetato de etila e insolúvel em ácido sulfúrico (National Center for Biotechnology Information, S.F.).
O sulfato de ferro III é ácido, sendo corrosivo para cobre, ligas de cobre, aço macio e aço galvanizado (FERRIC SULFATE, 2016).
Reatividade e perigos
O sulfato férrico é um composto estável não inflamável, porém, quando aquecido emite vapores tóxicos de ferro e óxidos de enxofre..
É muito perigoso em caso de ingestão, contato com a pele e os olhos (irritante) e inalação. A substância é tóxica para os pulmões e as membranas mucosas e a exposição repetida ou prolongada à substância pode causar danos a esses órgãos..
Em caso de contato com os olhos, as lentes de contato devem ser verificadas e removidas. Não se deve usar pomada para os olhos e procurar atendimento médico..
Em caso de contato com a pele, deve-se lavar imediata e abundantemente com água de forma delicada e tomando cuidado para não usar sabonete não abrasivo. Cubra a pele irritada com um emoliente; se a irritação persistir, procure atendimento médico.
Se o contato com a pele for grave, deve-se lavar com sabonete desinfetante e cobrir a pele contaminada com creme antibacteriano. Procurar atenção médica.
Em caso de inalação, a vítima deve descansar em área bem ventilada e procurar atendimento médico imediato..
Se ingerido, não induza ao vômito, mas, em vez disso, afrouxe as roupas apertadas, como o colarinho da camisa, gravata ou cinto. Se a vítima não estiver respirando, a ressuscitação boca-a-boca deve ser realizada. Como nos casos anteriores, deve-se procurar atendimento médico imediato..
Este tipo de composto não requer um tipo específico de armazenamento. São utilizadas prateleiras ou armários resistentes o suficiente para suportar o peso do produto químico, garantindo que não seja necessário esforço para atingir os materiais e que as prateleiras não fiquem sobrecarregadas (Folha de Dados de Segurança de Material Sulfato férrico, 2013).
Formulários
O sulfato férrico é utilizado na indústria, em operações de tratamento de água e efluentes devido à sua capacidade como floculante e coagulante e para eliminar o odor de compostos de enxofre..
O sulfato férrico é usado como agente de separação de sólidos e agente oxidante. Além disso, este sal é utilizado na indústria de pigmentos e na medicina, pode ser utilizado como adstringente e adstringente..
No trabalho de Ibricevic (2000), 70 dentes molares decíduos cariados expostos foram tratados, sem sintomas e sem qualquer sinal de reabsorção radicular em crianças de 3 a 6 anos (idade principal: 4,3 anos) tratadas com pulpotomia convencional.
Eles usaram uma solução de sulfato férrico a 15,5% (aplicada por 15 segundos para 35 dentes) e solução de formocresol (procedimento de fórmula de Buckley de 5 minutos para os próximos 35 dentes) como agentes de pulpotomia..
Em ambos os grupos, os cotos pulpares foram recobertos com pasta de óxido de zinco e eugenol. As restaurações permanentes foram coroas de aço inoxidável. O controle clínico foi a cada três meses e o acompanhamento radiográfico foi de seis e vinte meses após o tratamento..
Os resultados neste período revelaram uma taxa de sucesso clínico de 100% em ambos os grupos. A taxa de sucesso radiográfico foi de 97,2% em ambos os grupos, enquanto em 2,8% os casos apresentaram reabsorção radicular interna.
Sulfato férrico e jarosita foram detectados pelos dois Martian Rovers Spirit e Opportunity. Essas substâncias são indicativas de condições altamente oxidantes que prevalecem na superfície de Marte..
Referências
- Sulfato férrico. (2016). Retirado de chemicalbook: chemicalbook.com.
- FERRIC SULFATE. (2016). Obtido em cameochemicals: cameochemicals.noaa.gov.
- Fórmula do sulfato férrico. (2005-2017). Obtido em softschools: softschools.com.
- Ibricevic H1, a.-J. Q. (2000). Sulfato férrico como agente de pulpotomia em dentes decíduos: seguimento clínico de vinte meses. Clin Pediatr Dent 24 (4), 269-272.
- Folha de Dados de Segurança do Material Sulfato férrico. (2013, 21 de maio). Obtido do sciencelab.
- Centro Nacional de Informações sobre Biotecnologia. (S.F.). PubChem Compound Database; CID = 24826. Obtido em PubChem.
- Royal Society of Chemistry. (2015). Sulfato de ferro (III). Obtido de chemspider.
- O que acontece com o sulfato de ferro (III) (sulfato férrico) em solução aquosa? (2015, 8 de agosto). Obtido em stackexchange: stackexchange.com.


Ainda sem comentários