
Características, preparação, exemplos de soluções tampão

As soluções tampão ou tampões são aqueles que podem diminuir as mudanças de pH devido aos íons H3OU+ e OH-. Na ausência destes, alguns sistemas (como os fisiológicos) são prejudicados, pois seus componentes são muito sensíveis a mudanças bruscas de pH.
Assim como os amortecedores nos carros reduzem o impacto causado pelo seu movimento, os amortecedores fazem o mesmo, mas com a acidez ou basicidade da solução. Além disso, os tampões estabelecem uma faixa de pH específica dentro da qual são eficientes..

Caso contrário, os íons H3OU+ eles irão acidificar a solução (o pH cai para valores abaixo de 6), trazendo como consequência uma possível alteração no rendimento da reação. O mesmo exemplo pode ser aplicado para valores básicos de pH, ou seja, maiores que 7.
Índice do artigo
- 1 recursos
- 1.1 Composição
- 1.2 Eles neutralizam ácidos e bases
- 1.3 Eficiência
- 2 Preparação
- 3 exemplos
- 4 referências
Caracteristicas
Composição
Eles são essencialmente compostos por um ácido (HA) ou uma base fraca (B) e sais de sua base ou ácido conjugado. Conseqüentemente, existem dois tipos: tampões ácidos e tampões alcalinos..
Os tampões de ácido correspondem ao par HA / A-, para onde- é a base conjugada do ácido fraco HA e interage com íons - como o Na+- para formar sais de sódio. Sendo assim, o par permanece como HA / NaA, embora também possam ser sais de potássio ou cálcio.
Derivado do ácido fraco HA, ele protege as faixas de pH ácido (menos de 7) de acordo com a seguinte equação:
HA + OH- => A- + HdoisOU
No entanto, por ser um ácido fraco, sua base conjugada é parcialmente hidrolisada para regenerar parte do HA consumido:
PARA- + HdoisOU <=> HA + OH-
Por outro lado, os tampões alcalinos consistem no par B / HB+, onde HB+ é o ácido conjugado da base fraca. Geralmente, HB+ forma sais com íons cloreto, deixando o par como B / HBCl. Esses buffers tamponam faixas básicas de pH (maior que 7):
B + H3OU+ => HB+ + HdoisOU
E novamente, HB+ pode ser parcialmente hidrolisado para regenerar parte do B consumido:
HB+ + HdoisOU <=> B + H3OU+
Eles neutralizam ácidos e bases
Enquanto os tampões ácidos tamponam o pH ácido e os alcalinos tamponam o pH básico, ambos podem reagir com os íons H.3OU+ e OH- por meio dessas séries de equações químicas:
PARA- + H3OU+ => HA + HdoisOU
HB+ + Oh- => B + HdoisOU
Assim, no caso do par HA / A-, HA reage com íons OH-, enquanto um- -sua base conjugada reage com o H3OU+. Em relação ao par B / HB+, B reage com íons H3OU+, enquanto HB+ -seu ácido conjugado - com o OH-.
Isso permite que ambos os tampões neutralizem as espécies ácidas e básicas. O resultado do acima versus, por exemplo, a adição constante de moles de OH-, é a diminuição da variação do pH (ΔpH):
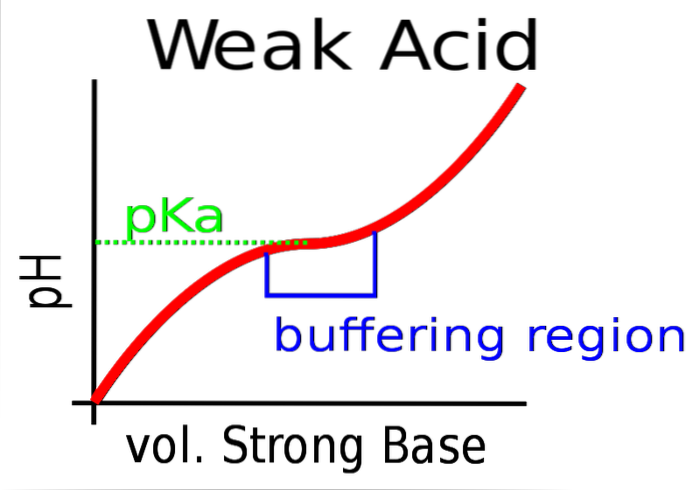
A imagem superior mostra o tamponamento do pH contra uma base forte (doador de OH-).
Inicialmente o pH é ácido devido à presença de HA. Quando a base forte é adicionada, os primeiros moles de A são formados- e o buffer começa a ter efeito.
No entanto, existe uma área da curva onde a inclinação é menos acentuada; ou seja, onde o amortecimento é mais eficiente (caixa azulada).
Eficiência
Existem várias maneiras de entender o conceito de eficiência de amortecimento. Uma delas é determinar a segunda derivada da curva pH versus volume de base, resolvendo V para o valor mínimo, que é Veq / 2.
Veq é o volume no ponto de equivalência; este é o volume de base necessário para neutralizar todo o ácido.
Outra maneira de entender isso é por meio da famosa equação de Henderson-Hasselbalch:
pH = pKpara + log ([B] / [A])
Aqui B denota a base, A o ácido e pKpara é o menor logaritmo da constante de acidez. Esta equação se aplica tanto para a espécie de ácido HA, quanto para o ácido conjugado HB+.
Se [A] é muito grande em relação a [B], o log () assume um valor muito negativo, que é subtraído do pKpara. Se, por outro lado, [A] é muito pequeno em relação a [B], o valor de log () assume um valor muito positivo, que é adicionado a pKpara. No entanto, quando [A] = [B], o log () é 0 e o pH = pKpara.
O que tudo isso significa? Que o ΔpH será maior nos extremos considerados para a equação, enquanto será mínimo com um pH igual ao pKpara; e como o pKpara é característico de cada ácido, este valor determina a faixa de pKpara± 1.
Os valores de pH dentro desta faixa são aqueles em que o tampão é mais eficiente..
Preparação
Para preparar uma solução tampão, você precisa manter as seguintes etapas em mente:
- Conheça o pH necessário e, portanto, aquele que você deseja manter o mais constante possível durante a reação ou processo.
- Conhecendo o pH, procura-se todos os ácidos fracos, aqueles cujo pKpara está mais perto desse valor.
- Depois de escolher a espécie de HA e calcular a concentração do tampão (dependendo de quanta base ou ácido precisa ser neutralizado), a quantidade necessária de seu sal de sódio é pesada..
Exemplos
O ácido acético tem um pKpara de 4,75, CH3COOH; portanto, uma mistura de certas quantidades deste ácido e acetato de sódio, CH3COONa, forma um tampão que protege eficientemente na faixa de pH (3,75-5,75).
Outros exemplos de ácidos monopróticos são os ácidos benzóicos (C6H5COOH) e fórmico (HCOOH). Para cada um desses seus valores de pKpara eles são 4,18 e 3,68; portanto, suas faixas de pH de tamponamento mais altas são (3,18-5,18) e (2,68-4,68).
Por outro lado, os ácidos polipróticos, como o fosfórico (H3PO4) e carbônico (HdoisCO3) têm tantos valores de pKpara como os prótons podem ser liberados. Assim, o H3PO4 tem três pKpara (2,12, 7,21 e 12,67) e o HdoisCO3 tem dois (6.352 e 10.329).
Se você deseja manter um pH de 3 em uma solução, você pode escolher entre HCOONa / HCOOH (pKpara= 3,68) e NaHdoisPO4/ H3PO4 (pKpara= 2,12).
O primeiro tampão, o de ácido fórmico, está mais próximo de pH 3 do que o tampão de ácido fosfórico; portanto, os tampões HCOONa / HCOOH são melhores em pH 3 do que NaHdoisPO4/ H3PO4.
Referências
- Day, R., & Underwood, A. Química Analítica Quantitativa (quinta edição). PEARSON Prentice Hall, p. 188-194.
- Avsar Aras. (20 de abril de 2013). Mini Choques. Obtido em 9 de maio de 2018, em: commons.wikimedia.org
- Wikipedia. (2018). Solução de buffer. Obtido em 9 de maio de 2018, em: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, PhD. [Doc.]. Soluções tampão. Universidade Médica de Varna.
- Chem Collective. Tutoriais de buffer. Obtido em 9 de maio de 2018, em: chemcollective.org
- AskIITians. (2018). Solução de buffer. Obtido em 9 de maio de 2018, em: askiitians.com
- Quimicas.net (2018). Exemplos de soluções tampão, tampão ou tampão. Obtido em 9 de maio de 2018, em: quimicas.net


Ainda sem comentários