
Estrutura, propriedades e usos do óxido de boro (B2O3)
O óxido de boro ou o anidrido bórico é um composto inorgânico cuja fórmula química é BdoisOU3. Como boro e oxigênio são elementos do bloco p da tabela periódica, e ainda mais cabeças de seus respectivos grupos, a diferença de eletronegatividade entre eles não é muito alta; portanto, é de se esperar que o BdoisOU3 é covalente por natureza.
O BdoisOU3 É preparado dissolvendo o bórax em ácido sulfúrico concentrado em um forno de fusão e a uma temperatura de 750 ° C; ácido bórico termicamente desidratante, B (OH)3, a uma temperatura de aproximadamente 300 ° C; ou também pode ser formado como um produto de reação de diborano (BdoisH6) com oxigênio.

O óxido de boro pode ter uma aparência vítrea semitransparente ou cristalina; o último por moagem pode ser obtido na forma de pó (imagem superior).
Embora possa não parecer à primeira vista, é considerado o BdoisOU3 como um dos óxidos inorgânicos mais complexos; não só do ponto de vista estrutural, mas também devido às propriedades variáveis adquiridas pelos vidros e cerâmicas aos quais se somam à sua matriz..
Índice do artigo
- 1 Estrutura do óxido de boro
- 1.1 unidade BO3
- 1.2 Estrutura de cristal
- 1.3 Estrutura vítrea
- 2 propriedades
- 2.1 Aparência física
- 2.2 Massa molecular
- 2.3 Sabor
- 2.4 Densidade
- 2.5 Ponto de fusão
- 2.6 Ponto de ebulição
- 2.7 Estabilidade
- 3 Nomenclatura
- 4 usos
- 4.1 Síntese de trihaletos de boro
- 4.2 Inseticida
- 4.3 Solvente de óxidos metálicos: formação de vidros, cerâmicas e ligas de boro
- 4.4 Aglutinante
- 5 referências
Estrutura de óxido de boro
Unidade BO3
O BdoisOU3 é um sólido covalente, portanto, em teoria, não há íons B em sua estrutura3+ nem Odois-, mas links B-O. O boro, de acordo com a teoria das ligações de valência (TEV), só pode formar três ligações covalentes; neste caso, três ligações B-O. Como conseqüência disso, a geometria esperada deve ser trigonal, BO3.
A molécula BO3 é deficiente em elétrons, especialmente átomos de oxigênio; no entanto, vários deles podem interagir entre si para suprir a referida deficiência. Assim, os triângulos BO3 unem-se compartilhando uma ponte de oxigênio e são distribuídos no espaço como redes de fileiras triangulares com seus planos orientados de maneiras diferentes.
Estrutura de cristal
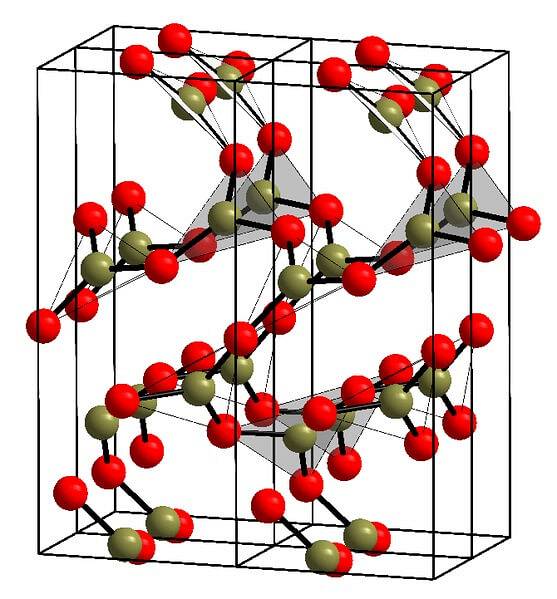
Um exemplo dessas linhas com unidades triangulares BO é mostrado na imagem acima.3. Se você olhar bem, nem todas as faces dos planos apontam para o leitor, mas o contrário. As orientações dessas faces podem ser responsáveis por como o B é definidodoisOU3 a uma certa temperatura e pressão.
Quando essas redes têm um padrão estrutural de longo alcance, trata-se de um sólido cristalino, que pode ser construído a partir de sua célula unitária. É aqui que se diz que o BdoisOU3 tem dois polimorfos cristalinos: α e β.
O α-BdoisOU3 é produzido à pressão ambiente (1 atm) e é considerado cineticamente instável; na verdade, esta é uma das razões pelas quais o óxido de boro é provavelmente um composto difícil de cristalizar.
O outro polimorfo, β-BdoisOU3, é obtido em altas pressões na faixa GPa; portanto, sua densidade deve ser maior que a de α-BdoisOU3.
Estrutura vítrea
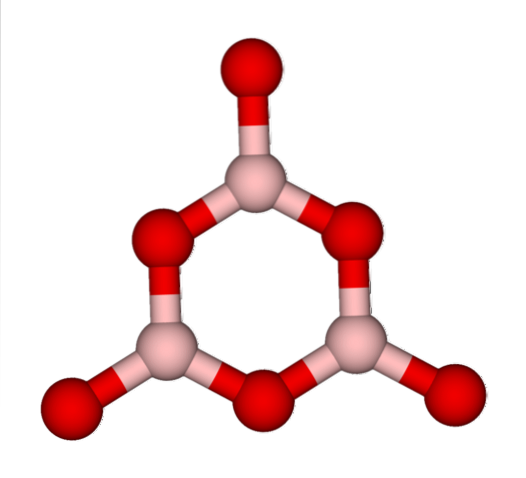
Redes BO3 eles naturalmente tendem a adotar estruturas amorfas; Ou seja, carecem de um padrão que descreva as moléculas ou íons no sólido. Ao sintetizar o BdoisOU3 sua forma predominante é amorfa e não cristalina; em palavras corretas: é um sólido mais vítreo do que cristalino.
Diz-se então que o BdoisOU3 é vítreo ou amorfo quando suas redes BO3 eles são bagunçados. Não só isso, mas também mudam a maneira como se reúnem. Em vez de serem organizados em uma geometria trigonal, eles acabam se ligando para criar o que os pesquisadores chamam de anel de boroxol (imagem superior).
Observe a diferença óbvia entre unidades triangulares e hexagonais. Triângulos caracterizam BdoisOU3 cristalino e hexagonal para BdoisOU3 vítreo. Outra forma de se referir a esta fase amorfa é o vidro de boro, ou por uma fórmula: g-BdoisOU3 (o 'g' vem da palavra vítreo, em inglês).
Assim, as redes g-BdoisOU3 são compostos de anéis de boroxol e não unidades de BO3. No entanto, o g-BdoisOU3 pode cristalizar em α-BdoisOU3, o que implicaria uma interconversão de anéis em triângulos, e também definiria o grau de cristalização alcançado.
Propriedades
Aparência física
É um sólido vítreo incolor. Em sua forma cristalina é branco.
Massa molecular
69,6182 g / mol.
Gosto
Ligeiramente amargo
Densidade
-Cristalino: 2,46 g / mL.
-Vítreo: 1,80g / mL.
Ponto de fusão
Não tem um ponto de fusão totalmente definido, porque depende de quão cristalino ou vítreo ele é. A forma puramente cristalina funde a 450 ° C; entretanto, a forma vítrea derrete em uma faixa de temperatura de 300 a 700ºC..
Ponto de ebulição
Novamente, os valores relatados não correspondem a este valor. O óxido de boro aparentemente líquido (fundido de seus cristais ou de seu vidro) ferve a 1860ºC.
Estabilidade
Deve ser mantido seco, pois absorve umidade para se transformar em ácido bórico, B (OH)3.
Nomenclatura
O óxido de boro pode ser denominado de outras maneiras, como:
-Trióxido de diboro (nomenclatura sistemática).
-Óxido de boro (III) (nomenclatura de estoque).
-Óxido bórico (nomenclatura tradicional).
Formulários
Alguns dos usos do óxido de boro são:
Síntese de trihaletos de boro
De BdoisOU3 podem ser trihaletos de boro sintetizados, BX3 (X = F, Cl e Br). Esses compostos são ácidos de Lewis, e com eles é possível introduzir átomos de boro em certas moléculas para obter outros derivados com novas propriedades..
Inseticida
Uma mistura sólida com ácido bórico, BdoisOU3-B (OH)3, representa uma fórmula que é usada como inseticida doméstico.
Solvente para óxidos metálicos: formação de vidros, cerâmicas e ligas de boro
O óxido de boro líquido é capaz de dissolver óxidos de metal. A partir dessa mistura resultante, uma vez resfriada, são obtidos sólidos compostos de boro e metais..
Dependendo da quantidade de BdoisOU3 usados, bem como a técnica e o tipo de óxido de metal, uma rica variedade de vidros (borossilicatos), cerâmicas (nitretos e carbonetos de boro) e ligas (se apenas metais forem usados) podem ser obtidos.
Em geral, o vidro ou a cerâmica adquirem maior resistência e resistência, além de maior durabilidade. No caso dos óculos, eles acabam sendo usados para lentes ópticas, telescópicas e aparelhos eletrônicos..
Encadernador
Na construção de fornos de fundição de aço, são utilizados tijolos refratários à base de magnésio. O óxido de boro é usado como aglutinante, ajudando a mantê-los juntos..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Trióxido de boro. Recuperado de: en.wikipedia.org
- PubChem. (2019). Óxido bórico. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Óxido de Borix. 20 Mule Team Borax. Recuperado de: borax.com
- A. Mukhanov, O. O. Kurakevich e V. L. Solozhenko. (s.f.). Sobre a dureza do óxido de boro (III). LPMTMCNRS, Université Paris Nord, Villetaneuse, França.
- Hansen T. (2015). BdoisOU3 (Óxido bórico). Recuperado de: digitalfire.com


Ainda sem comentários