
História do bórax, estrutura, propriedades, usos, síntese, riscos
O bórax ou borato de sódio é uma designação para um grupo de compostos químicos com uma fórmula base de NadoisB4OU7. É um sal higroscópico capaz de formar inúmeros hidratos, além de ser estruturalmente enriquecido pela presença de certas impurezas metálicas..
Os principais compostos que recebem o nome de bórax são os seguintes: tetraborato de sódio anidro, NadoisB4OU7; tetraborato de sódio pentahidratado (NadoisB4OU7) .5HdoisOU; e decahidrato de tetraborato de sódio, NadoisB4OU7.10hdoisOu, ou seu equivalente, tetraborato de sódio octahidratado, NadoisB4OU5(OH)4.8hdoisOU.

Como pode ser apreciado, todos os sólidos acima diferem apenas em seu grau de hidratação; alguns têm mais moléculas de água em seus cristais do que outros. Fisicamente, o bórax se parece com pedaços resistentes ou cristais de giz (imagem superior).
O bórax é encontrado naturalmente em sedimentos lacustres sazonais, secos por evaporação. O bórax é produzido na Turquia, Searles Lakes (Califórnia), no Deserto de Atacama, Chile, Bolívia, Tibete e Romênia. Os cristais de bórax podem ser obtidos sinteticamente por um processo de nucleação lenta; ou seja, aquele em que o crescimento de cristais é favorecido.
O tetraborato de sódio, anidro e desidratado, é pouco solúvel em água fria; mas sua solubilidade aumenta com o aumento da temperatura. Então umadoisB4OU7.10hdoisOu é muito solúvel em etilenoglicol, moderadamente solúvel em etanol e ligeiramente solúvel em acetona; estes são solventes menos polares do que água.
O bórax tem inúmeras aplicações, como na fabricação de detergentes e sabões; como um retardador de fogo para material celulósico; na produção de fibra de vidro; na limpeza de superfícies duras como metais, vidro e cerâmica; e na inibição da corrosão, entre outros usos.
O bórax é irritante para os olhos, a pele e o trato respiratório. Por ingestão, pode produzir, entre outros sintomas, vômitos, diarréia, flacidez, cáries e convulsões. Atualmente, suspeita-se que pode ter efeitos prejudiciais à reprodução humana.
Índice do artigo
- 1 história
- 2 Estrutura do bórax
- 3 cristais
- 3.1 Confusões com o ânion borato
- 4 propriedades
- 4.1 Nomes
- 4.2 Massa molecular
- 4.3 Aparência física
- 4.4 Densidade
- 4.5 Ponto de fusão
- 4.6 Ponto de ebulição
- 4.7 Solubilidade em água
- 4.8 Solubilidade em solventes orgânicos
- 4.9 Índice de refração (ηD)
- 4.10 Estabilidade
- 4.11 Emissão de luz
- 4.12 Reações
- 5 usos
- 5.1 Ação antioxidante
- 5.2 Fabricação de adesivos
- 5.3 Retardante de fogo
- 5.4 Fabricação de vidro de borosilicato (Pyrex)
- 5.5 Emulsificador
- 5.6 Material de limpeza
- 5.7 Usos médicos
- 5,8 pH tampão
- 5,9 Diminuição da dureza da água
- 5.10 Fertilizante e composto
- 5.11 Preservação de madeira
- 5,12 Fluxo e fluxo
- 5.13 Outros
- 6 Síntese
- 7 riscos
- 8 referências
História
A história do bórax é confusa. Diz-se que foi descoberto no leito de um lago no Tibete, seco por evaporação. Foi transferida no século 8 do Tibete para a Arábia Saudita, seguindo a chamada Rota da Seda.
O termo "bórax" tornou-se popular como resultado das inúmeras aplicações que foram encontradas e comercializadas sob o nome de 20 Mule Team Borax Tradermax, que se referia à forma como o bórax era transportado pelos desertos de Nevada e Califórnia.
Outra versão de sua descoberta indica que os egípcios sabiam de sua existência há muito tempo, utilizando-o na soldagem de metais por calor. Além disso, eles o usavam na medicina e no processo de mumificação. O bórax foi transferido para a Europa no século 13 por Marco Polo.
Em meados do século 19, grandes depósitos de bórax foram descobertos no Deserto de Mogave, que tornou seu uso comum desde então..
Estrutura do bórax

A imagem superior mostra os íons que compõem o bórax, correspondendo especificamente a um sólido com uma fórmula composicional de Nadois[B4OU5(OH)4] · 8HdoisO (ou NadoisB4OU710hdoisOU).
Primeiro, a estrutura enjaulada do ânion [B4OU5(OH)4]dois- (embora deva ter dois grupos -OH desprotonados, -O-), em que um anel octogonal (quatro átomos B e quatro O) pode ser visto, com uma ponte B-O-B dividindo-o em duas metades.
A referida gaiola não permanece estática, mas vibra e adota diferentes formas no espaço; no entanto, em menor grau nas proximidades da ponte. Além disso, pode-se notar que é muito "oxigenado"; ou seja, tem muitos átomos de oxigênio, capazes de interagir com as moléculas de água por meio de ligações de hidrogênio.
Não é surpreendente, então, que os cristais de bórax podem hidratar e gerar vários hidratos. Assim, para o Na sólidodois[B4OU5(OH)4] · 8HdoisOu, existem oito moléculas de HdoisOu interagindo com a gaiola de borato e, ao mesmo tempo, com os centros metálicos do Na+.
Do lado do cátion, temos o complexo aquoso [Na (HdoisOU)4]+n, onde o valor de n dependerá da razão ânion / cátion. No sólido superior, n = 2, então temos: [Nadois(HdoisOU)8]dois+, cuja carga 2+ neutraliza a carga 2 do ânion borato.
Cristais
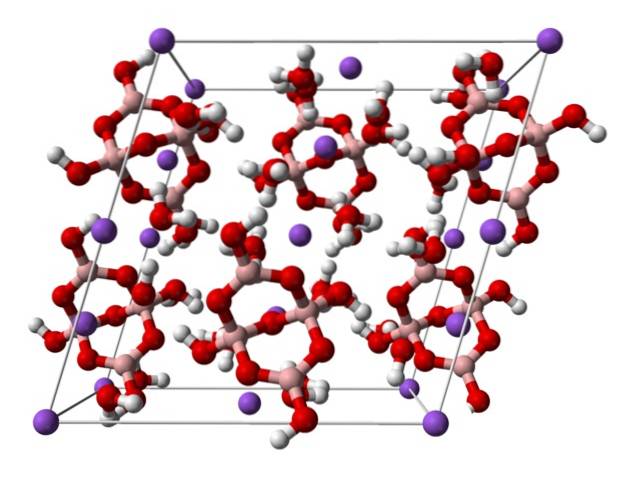
domínio].
Acima está a célula unitária monoclínica para cristais de Nadois[B4OU5(OH)4] · 8HdoisO ou NadoisB4OU710hdoisO. Aqui as atrações eletrostáticas e as ligações de hidrogênio governam ou dominam os padrões estruturais originados em cada extensão do cristal..
Os demais hidratos e o sal anidro perdem uma ou todas as moléculas de água, alterando a composição e estrutura do cristal de bórax. Em todos eles, o ânion e o cátion permanecem os mesmos (a menos que haja impurezas ou reações colaterais), então não pode haver confusão a esse respeito..
Confusões com o ânion borato
N / Ddois[B4OU5(OH)4] · 8HdoisO e NadoisB4OU710hdoisOu eles são iguais. Por que?
Em primeiro lugar, se você contar seus átomos, verá que eles coincidem em número; e em segundo lugar, no ânion B4OU7dois- considera-se a ausência dos dois grupos OH ligados às cabeças de boro das pontes B-O-B; dois OH que, junto com os dois H+ vindo de B4OU7dois-, adicionar 2 HdoisOu, dando um total de 10 HdoisOu (8 + 2).
Propriedades
Nomes
- Bórax.
- Borato de sódio.
- Tetraborato de sódio.
- Tetraborato dissódico.
Massa molecular
Anidro: 201,22 g / mol.
Decahidrato: 381,38 g / mol.
Aparência física
Um sólido cristalino branco.
Densidade
Anidro: 2,4 g / cm3
Decahidrato: 1.739 g / cm3
Ponto de fusão
Anidro: 743ºC (1.369ºF, 1.016K).
Decahidrato: 75 ºC.
Ponto de ebulição
Anidro: 1.575ºC (2.867ºF, 1.848K).
Solubilidade em água
31,78 g / L (para anidro e decahidrato).
Solubilidade em solventes orgânicos
É muito solúvel em etilenoglicol, moderadamente solúvel em dietilenoglicol e metanol e ligeiramente solúvel em acetona..
Índice de refração (ηD)
Anidro: η1 = 1.447; ηdois = 1.469.
Decahidrato: ηdois = 1.472.
Estabilidade
É estável sob condições adequadas de armazenamento. Embora tenha uma baixa pressão de vapor, aumenta com a temperatura, levando à cristalização e condensação, portanto flutuações excessivas de temperatura e umidade devem ser evitadas..
Emissão de luz
O tetraborato de sódio quando sujeito à ação do fogo emite luz verde.
Reações
- Quando se dissolve em água, produz soluções alcalinas com um pH em torno de 9,2.
- O bórax reage para formar outros boratos, como perborato (PBS).
- Também produz ácido bórico ao reagir com ácido clorídrico:
N / DdoisB4OU710hdoisO + HCl => 4 H3BO3 + 2 Na+ + 2 Cl- + 5 hdoisOU
- O tetraborato de sódio se comporta como uma substância anfotérica, pois em solução aquosa hidrolisa e é capaz de neutralizar ácidos. Da mesma forma, é capaz de neutralizar álcalis em altas concentrações, evitando o aumento excessivo do pH do meio..
Formulários
O Borax tem inúmeras aplicações, tanto em humanos como em todas as atividades que realizam..
Ação antioxidante
O bórax tem a capacidade de dissolver óxidos. Por isso é utilizado na recuperação de metais como latão, cobre, chumbo e zinco..
Também é usado para prevenir a oxidação de barras de metal em fundições. O bórax cobre sua superfície, excluindo o ar e, portanto, evitando a oxidação. Além disso, evita a corrosão de material ferroso na fabricação de automóveis.
A solubilidade do bórax em etilenoglicol tem sido útil em formulações anticongelantes. O bórax neutraliza os resíduos ácidos que são produzidos durante a decomposição do etilenoglicol, minimizando a oxidação que a superfície dos metais pode sofrer..
Fabricação de adesivos
- O bórax faz parte de uma formulação de adesivo de amido para papelão ondulado e papelão.
- É um agente peptizante na fabricação de adesivos à base de caseína e dextrina.
- Ele age fortalecendo os materiais adesivos por meio da reticulação de grupos hidroxila conjugados.
Retardante de fogo
É usado como retardante de fogo em materiais celulósicos e outros polímeros que contêm grupos hidroxila. Ela exerce sua ação por meio de diversos mecanismos, entre eles a formação de uma camada vítrea que limita o acesso aos combustíveis..
Fabricação de vidro de borosilicato (Pyrex)
O bórax é uma fonte de boro usada na fabricação de vidro de borossilicato; caracterizado por um alto ponto de fusão, baixo coeficiente de expansão e alta resistência ao choque térmico.
Isso permite que seja submetido a altas temperaturas sem sofrer fraturas, recebendo o nome de vidro refratário..
O vidro borosilicato é utilizado na fabricação de materiais para uso doméstico na preparação de alimentos. Também é usado em laboratórios em béqueres, frascos, cilindros de medição, pipetas, etc..
Emulsionante
O bórax, junto com outros compostos, é usado para emulsionar sabões e outras parafinas. Também é utilizado como base para a produção de loções, cremes e pomadas..
Produtos de limpeza
- É adicionado em formulações para limpar superfícies firmes, como metais, vidro e cerâmica.
- É utilizado em limpadores de mãos, materiais de polimento e sabonetes detergentes para uso em lavanderias e em casa. Além disso, facilita a remoção de depósitos oleosos do chão de fábrica.
Usos médicos
- É usado no tratamento de infecções fúngicas dos pés.
- Faz parte da fórmula dos nutrientes que fornecem o boro. Acredita-se que este elemento esteja envolvido no metabolismo do cálcio, fósforo e magnésio e pode ser necessário para a estrutura óssea.
- Está envolvido na determinação da hemoglobina glicosilada (HbA1C), um teste que serve para determinar o desenvolvimento de longo prazo do diabetes em um paciente, já que a meia-vida de um eritrócito é de 120 dias.
Essas informações são mais úteis para o médico do que medições individuais de glicose no sangue do paciente..
Buffer PH
É usado em vários sistemas tampão usados em bioquímica; entre eles, o Tris (hidroximetil) aminometano-borato, utilizado na eletroforese de poliacrilamida de ácidos nucléicos de DNA e RNA..
Diminuição da dureza da água
O bórax é capaz de se combinar com os íons cálcio e magnésio presentes na água, reduzindo sua concentração. Desta forma, a dureza da água é reduzida.
Fertilizante e composto
O bórax é usado como fonte de boro. O cálcio e o boro estão envolvidos na formação da parede celular da planta. Além disso, foi apontado que o boro favorece a polinização, por isso intervém na fertilização e proliferação das plantas..
Preservação de madeira
O bórax combate o caruncho, um besouro que consome e destrói madeira. Também é utilizado na conservação e manutenção de barcos de madeira..
Fluxo e fluxo
É utilizado como fundente na soldagem de aço e ferro, causando diminuição do ponto de fusão e eliminação do óxido de ferro; um contaminante indesejável. Para um propósito semelhante, ele participa da soldagem de ouro e prata.
Outras
- É usado como um pesticida suave; por exemplo, para combater mariposas na lã.
- A pulverização é utilizada para o controle de pragas presentes em gabinetes, tanques internos, nos ocos das paredes e, em geral, onde não se deseja o uso de defensivos mais poluentes..
- É usado em reatores nucleares para controlar reações que poderiam produzir, em casos extremos, uma reação em cadeia.
- Em radiadores de automóveis, o bórax é usado para bloquear locais onde há vazamentos de água.
Síntese
O bórax é obtido pela reação do mineral ulexita, composto pelos elementos boro, sódio e cálcio, com a fórmula NaCaB5OU9.8hdoisOu, com carbonato de sódio e hidrocarbonato de sódio em meio aquoso.
Na verdade, a síntese de tetraborato de sódio ou bórax é pouco utilizada; a maior parte do composto produzido é obtido pela extração dos minerais que o contêm.
O processo pode ser resumido em uma dissolução do minério em água, seguida por uma filtração em argila e finalmente uma evaporação da solução aquosa..
Riscos
O bórax é um produto natural, porém pode causar uma série de danos à saúde humana. Por exemplo, o contato com o pó de bórax pode causar irritação na pele que pode levar à dermatite..
Da mesma forma, o bórax causa irritação nos olhos e no trato respiratório superior. Os sintomas de inalação incluem tosse e dor de garganta.
Enquanto isso, a ingestão de bórax apresenta os seguintes sintomas: vômitos, náuseas, diarreia, flacidez, dor de cabeça e convulsões. Além disso, o sistema nervoso central e a função renal podem ser afetados..
A partir de estudos realizados em ratos machos, alimentados com bórax, foi observada atrofia testicular nos mesmos. Enquanto estudos realizados com ratas grávidas indicaram que o bórax pode atravessar a placenta, produzindo uma alteração do desenvolvimento fetal, manifestada pelo baixo peso ao nascer.
Acredita-se que a exposição ao bórax afete a função reprodutiva masculina nos homens, manifestada por uma redução na contagem de espermatozoides.
Uma dose fatal de 10 a 25 gramas é estimada para a ingestão de bórax em adultos.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Argônio. Banco de dados PubChem. CID = 23968. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph e Dr. Ryan Baumbach. (s.f.). Síntese e propriedades de cristais de bórax e ligas intermetálicas. Recuperado de: nationalmaglab.org
- Wikipedia. (2019). Bórax. Recuperado de: en.wikipedia.org
- Rio Tinto. (2019). Borax decahydrate. 20 Mule Team Borax. Recuperado de: borax.com
- Fletcher Jenna. (14 de janeiro de 2019). O bórax é seguro para uso? Recuperado de: medicalnewstoday.com


Ainda sem comentários