
Descoberta de rênio, propriedades, estrutura, usos
O rênio É um elemento metálico cujo símbolo químico é Re, e está localizado no grupo 7 da tabela periódica, dois lugares abaixo do manganês. Ele compartilha com este e o tecnécio a propriedade de exibir vários números ou estados de oxidação, de +1 a +7. Ele também forma um ânion chamado perrenato, ReO4-, análogo ao permanganato, MnO4-.
Este metal é um dos mais raros e raros da natureza, por isso seu preço é alto. É extraído como subproduto da mineração de molibdênio e cobre. Uma das propriedades mais relevantes do rênio é seu alto ponto de fusão, mal superado pelo carbono e tungstênio, e sua alta densidade, sendo o dobro do chumbo..

Sua descoberta tem conotações controversas e infelizes. O nome 'rhenium' deriva da palavra latina 'rhenus', que significa Reno, o famoso rio alemão perto do local onde trabalharam os químicos alemães que isolaram e identificaram este novo elemento..
O rênio tem inúmeras aplicações, entre as quais se destaca o refinamento do número de octanas da gasolina, bem como na fabricação de superligas refratárias, destinadas à montagem de turbinas e motores de navios aeroespaciais..
Índice do artigo
- 1 descoberta
- 2 Propriedades do rênio
- 2.1 Aparência física
- 2,2 massa molar
- 2.3 Número atômico
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Densidade
- 2.7 Eletronegatividade
- 2.8 Energias de ionização
- 2,9 capacidade de calor molar
- 2.10 Condutividade térmica
- 2.11 Resistividade elétrica
- 2.12 Dureza de Mohs
- 2.13 Isótopos
- 2.14 Reatividade
- 3 Estrutura e configuração eletrônica
- 3.1 números de oxidação
- 4 usos
- 4.1 Gasolina
- 4.2 Superligas refratárias
- 4.3 Filamentos de tungstênio
- 5 referências
Descoberta
A existência de dois elementos pesados com características químicas semelhantes às do manganês já havia sido prevista desde os anos 1869, por meio da tabela periódica do químico russo Dmitri Mendeleev. No entanto, não se sabia até então quais deveriam ser seus números atômicos; e foi aqui em 1913 que a previsão do físico inglês Henry Moseley foi introduzida.
Segundo Moseley, esses dois elementos pertencentes ao grupo do manganês devem ter números atômicos 43 e 75.
Alguns anos antes, porém, o químico japonês Masataka Ogawa havia descoberto o suposto elemento 43 em uma amostra do mineral torianita. Depois de anunciar seus resultados em 1908, ele quis batizar esse elemento com o nome de 'Nipônio'. Infelizmente, os químicos da época provaram que Ogawa não havia descoberto o elemento 43..
E assim, outros anos se passaram quando, em 1925, três químicos alemães: Walter Noddack, Ida Noddack e Otto Berg, encontraram o elemento 75 em amostras de minerais de columbita, gadolinita e molibdenita. Estes deram-lhe o nome de rénio, em homenagem ao rio Reno da Alemanha ('Rhenus', em latim).
O erro de Masataka Ogawa foi ter feito a identificação errada do elemento: ele havia descoberto o rênio, não o elemento 43, hoje chamado de tecnécio..
Propriedades do rênio
Aparência física
O rênio é geralmente comercializado como um pó acinzentado. Suas peças metálicas, geralmente gotas esféricas, são cinza-prateadas, também muito brilhantes..
Massa molar
186,207 g / mol
Número atômico
75
Ponto de fusão
3186 ºC
Ponto de ebulição
5630 ºC
Densidade
-À temperatura ambiente: 21,02 g / cm3
-Bem no ponto de fusão: 18,9 g / cm3
O rênio é um metal quase duas vezes mais denso que o próprio chumbo. Assim, uma esfera de rênio pesando 1 grama pode ser equiparada a um cristal de chumbo robusto da mesma massa.
Eletro-negatividade
1,9 na escala de Pauling
Energias de ionização
Primeiro: 760 kJ / mol
Segundo: 1260 kJ / mol
Terceiro: 2510 kJ / mol
Capacidade de calor molar
25,48 J / (mol K)
Condutividade térmica
48,0 W / (mK)
Resistividade elétrica
193 nΩ m
Dureza de Mohs
7
Isótopos
Os átomos de rênio ocorrem na natureza como dois isótopos: 185Re, com abundância de 37,4%; Y 187Re, com abundância de 62,6%. O rênio é um daqueles elementos cujo isótopo mais abundante é radioativo; no entanto, a meia-vida do 187Re é muito grande (4.121010 anos), por isso é praticamente considerado estável.
Reatividade
O metal rênio é um material resistente à ferrugem. Quando isso acontece, sua ferrugem, RedoisOU7, ele volatiliza em altas temperaturas e queima com uma chama verde-amarelada. Pedaços de rênio resistem ao ataque HNO3 concentrado; mas quando quente, ele se dissolve para gerar ácido rênico e dióxido de nitrogênio, o que torna a solução marrom:
Re + 7HNO3 → HReO4 + 7 NÃOdois + 3HdoisOU
A química do rênio é vasta, pois ele é capaz de formar compostos com um amplo espectro de números de oxidação, além de estabelecer uma ligação quadrupolar entre dois átomos de rênio (quatro ligações covalentes Re-Re)..
Estrutura e configuração eletrônica
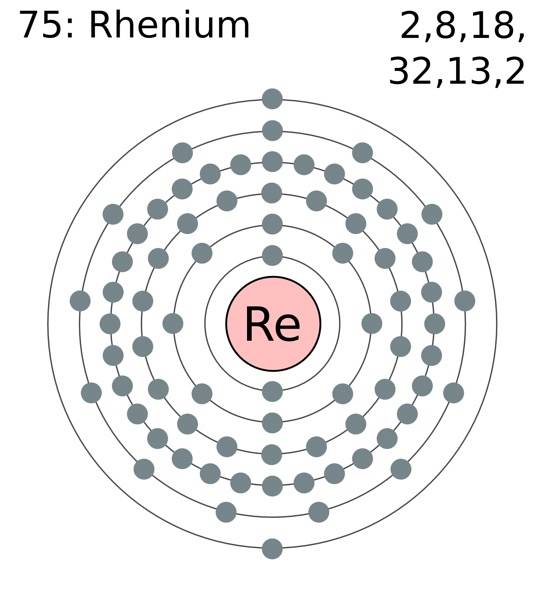
Os átomos de rênio se agrupam em seus cristais para formar uma estrutura hexagonal compacta, hcp, que se caracteriza por ser muito densa. Isso é consistente com o fato de ser um metal de alta densidade. A ligação metálica, produto da sobreposição de seus orbitais externos, mantém os átomos de Re fortemente coesos.
Nessa ligação metálica, Re-Re, participam os elétrons de valência, que estão de acordo com a configuração eletrônica:
[Xe] 4f14 5 d5 6sdois
Em princípio, são os orbitais 5d e 6s que se sobrepõem para compactar os átomos Re na estrutura hcp. Observe que seus elétrons somam um total de 7, correspondendo ao número de seu grupo na tabela periódica..
Números de oxidação
A configuração eletrônica do rênio nos permite ver de uma só vez que seu átomo é capaz de perder até 7 elétrons, para se tornar o cátion hipotético Re.7+. Quando a existência do Re é assumida7+ em qualquer composto de rênio, por exemplo, em RedoisOU7 (Rédois7+OU7dois-), é dito ter um número de oxidação de +7, Re (VII).
Outros números de oxidação positivos para o rênio são: +1 (Re+), +2 (Redois+), +3 (Re3+) e assim por diante até +7. Além disso, o rênio pode ganhar elétrons ao se tornar um ânion. Nestes casos, diz-se que tem um número de oxidação negativo: -3 (Re3-), -2 (Redois-) e -1 (Re-).
Formulários
Gasolina
O rênio, junto com a platina, é usado para criar catalisadores que aumentam a octanagem da gasolina, enquanto reduzem seu teor de chumbo. Por outro lado, os catalisadores de rênio são usados para múltiplas reações de hidrogenação, isso devido à sua resistência ao envenenamento por nitrogênio, fósforo e enxofre..
Superligas refratárias
O rênio é um metal refratário devido ao seu alto ponto de fusão. Por isso é adicionado às ligas de níquel para torná-las refratárias e resistentes a altas pressões e temperaturas. Essas superligas são usadas principalmente para o projeto de turbinas e motores de navios aeroespaciais..
Filamentos de tungstênio
O rênio também pode formar ligas com o tungstênio, o que melhora sua ductilidade e, portanto, facilita a fabricação dos filamentos. Esses filamentos de rênio-tungstênio são usados como fontes de raios-X e para o projeto de termopares capazes de medir temperaturas de até 2.200 ºC..
Da mesma forma, esses filamentos de rênio já foram usados para flashes de câmeras arcaicas e agora para lâmpadas de equipamentos sofisticados; como o espectrofotômetro de massa.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Sarah Pierce. (2020). Rênio: usos, história, fatos e isótopos. Estudar. Recuperado de: study.com
- Centro Nacional de Informações sobre Biotecnologia. (2020). Rênio. Banco de dados PubChem., CID = 23947. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Rênio. Recuperado de: en.wikipedia.org
- Dr. Doug Stewart. (2020). Fatos sobre o elemento rênio. Recuperado de: chemicool.com
- Eric Scerri. (18 de novembro de 2008). Rênio. Química em seus elementos. Recuperado de: chemicalworld.com



Ainda sem comentários