
Campo de estudo e aplicações da química ambiental
O química ambiental estuda os processos químicos que ocorrem a nível ambiental. É uma ciência que aplica princípios químicos ao estudo do desempenho ambiental e dos impactos gerados pelas atividades humanas..
Além disso, a química ambiental projeta técnicas de prevenção, mitigação e remediação para os danos ambientais existentes..
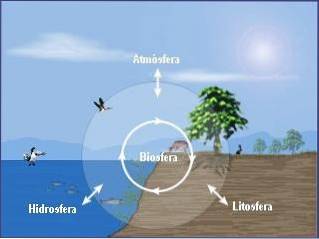
A química ambiental pode ser subdividida em três disciplinas básicas que são:
- Química ambiental da atmosfera.
- Química ambiental da hidrosfera.
- Química ambiental do solo.
Uma abordagem integral à química ambiental também requer o estudo das inter-relações entre os processos químicos que ocorrem nesses três compartimentos (atmosfera, hidrosfera, solo) e suas relações com a biosfera..
Índice do artigo
- 1 Química ambiental da atmosfera
- 1.1-Estratosfera
- 1.2 -Troposfera
- 2 Química ambiental da hidrosfera
- 2.1 - Água fresca
- 2.2 - O ciclo da água
- 2.3 - Impactos antropológicos no ciclo da água
- 3 Química ambiental do solo
- 3.1 O solo
- 3.2 Impactos antropológicos no solo
- 4 Relação químico-ambiente
- 4.1 -Modelo Garrels e Lerman
- 5 aplicações da química ambiental
- 6 referências
Química ambiental da atmosfera
A atmosfera é a camada de gases que envolve a Terra; constitui um sistema muito complexo, onde a temperatura, pressão e composição química variam com a altitude em faixas muito amplas.
O sol bombardeia a atmosfera com radiação e partículas de alta energia; este fato tem efeitos químicos muito significativos em todas as camadas da atmosfera, mas em particular, nas camadas superiores e externas.
-Estratosfera
As reações de fotodissociação e fotoionização ocorrem nas regiões externas da atmosfera. Na região entre 30 e 90 km de altura medida a partir da superfície terrestre, na estratosfera, existe uma camada que contém principalmente ozônio (O3), chamada de camada de ozônio.
Camada de ozônio
O ozônio absorve a radiação ultravioleta de alta energia que vem do sol e, se não fosse pela existência dessa camada, nenhuma forma de vida conhecida no planeta poderia sobreviver..
Em 1995, os químicos atmosféricos Mario J. Molina (mexicano), Frank S. Rowland (americano) e Paul Crutzen (holandês), ganharam o Prêmio Nobel de Química por suas pesquisas sobre a destruição e empobrecimento do ozônio na estratosfera..
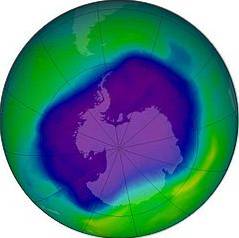
Em 1970, Crutzen mostrou que os óxidos de nitrogênio destroem o ozônio por meio de reações químicas catalíticas. Mais tarde, Molina e Rowland, em 1974, mostraram que o cloro nos compostos de clorofluorocarbono (CFC's) também é capaz de destruir a camada de ozônio.
-Troposfera
A camada atmosférica imediata à superfície da Terra, entre 0 a 12 km de altura, chamada de troposfera, é composta principalmente de nitrogênio (Ndois) e oxigênio (Odois).
Gases tóxicos
Como resultado das atividades humanas, a troposfera contém muitos produtos químicos adicionais considerados poluentes do ar, tais como:
- Dióxido de carbono e monóxido (COdois e companhia).
- Metano (CH4).
- Óxido de nitrogênio (NO).
- Dióxido de enxofre (SOdois).
- Ozone O3 (considerado poluente na troposfera)
- Compostos orgânicos voláteis (VOC's), pós ou partículas sólidas.
Entre muitas outras substâncias, que afetam a saúde humana, vegetal e animal.
Chuva ácida
Óxidos de enxofre (SOdois Eu sou3) e os de nitrogênio, como óxido nitroso (NOdois), causa outro problema ambiental chamado chuva ácida.
Esses óxidos, presentes na troposfera principalmente como produtos da combustão de combustíveis fósseis nas atividades industriais e de transporte, reagem com a água da chuva produzindo ácido sulfúrico e ácido nítrico, com a conseqüente precipitação ácida..
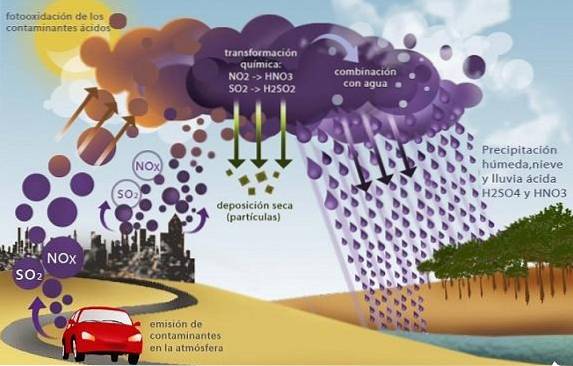
Ao precipitar essa chuva que contém ácidos fortes, ela desencadeia diversos problemas ambientais, como a acidificação dos mares e das águas doces. Isso causa a morte de organismos aquáticos; a acidificação dos solos que causa a morte das plantações e a destruição por ação química corrosiva de edifícios, pontes e monumentos.
Outros problemas ambientais atmosféricos são a poluição fotoquímica, causada principalmente por óxidos de nitrogênio e ozônio troposférico.
Aquecimento global
O aquecimento global é produzido por altas concentrações de COdois gases atmosféricos e outros gases de efeito estufa (GEEs), que absorvem grande parte da radiação infravermelha emitida pela superfície da Terra e prendem o calor na troposfera. Isso gera mudanças climáticas no planeta.
Química ambiental da hidrosfera
A hidrosfera é composta por todos os corpos d'água da Terra: superfície ou pântanos - oceanos, lagos, rios, nascentes - e subterrâneos ou aquíferos..
-Água fresca
A água é a substância líquida mais comum no planeta, cobre 75% da superfície terrestre e é absolutamente essencial para a vida..
Todas as formas de vida dependem de água doce (definida como água com teor de sal inferior a 0,01%). 97% da água do planeta é salgada.
Dos 3% restantes de água doce, 87% está em:
- Os pólos da Terra (que estão derretendo e se derramando nos mares como resultado do aquecimento global).
- Geleiras (também em processo de desaparecimento).
- Lençóis freáticos.
- Água na forma de vapor presente na atmosfera.
Apenas 0,4% do total de água doce do planeta está disponível para consumo. A evaporação da água dos oceanos e as chuvas fornecem continuamente essa pequena porcentagem..
A química ambiental da água estuda os processos químicos que ocorrem no ciclo da água ou ciclo hidrológico e também desenvolve tecnologias para a purificação da água para consumo humano, o tratamento das águas residuais industriais e urbanas, a dessalinização da água do mar, a reciclagem e poupança deste recurso, entre outros.
-O ciclo da Agua
O ciclo da água na Terra consiste em três processos principais: evaporação, condensação e precipitação, dos quais três circuitos são derivados:
- Escoamento superficial
- Evapotranspiração da planta
- A infiltração, na qual a água passa para níveis subterrâneos (freáticos), circula pelos canais do aquífero e sai por nascentes, fontes ou poços.
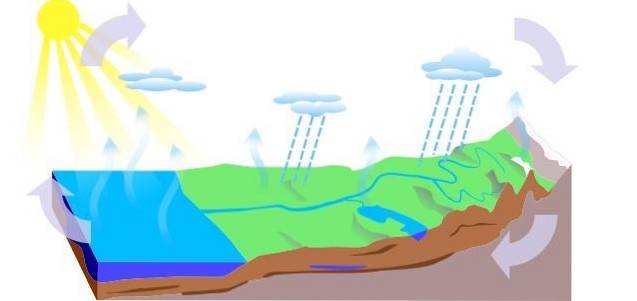
-Impactos antropológicos no ciclo da água
A atividade humana tem impactos no ciclo da água; algumas das causas e efeitos da ação antropológica são as seguintes:
Modificação da superfície da terra
É gerado pela destruição de florestas e campos com desmatamento. Isso afeta o ciclo da água, eliminando a evapotranspiração (ingestão de água pelas plantas e retorno ao meio ambiente por transpiração e evaporação) e aumentando o escoamento superficial..
O aumento do escoamento superficial produz um aumento no fluxo dos rios e inundações.
A urbanização também modifica a superfície do solo e afeta o ciclo da água, pois o solo poroso é substituído por cimento impermeável e asfalto, o que impossibilita a infiltração..
Poluição do ciclo da água
O ciclo da água envolve toda a biosfera e, consequentemente, os resíduos gerados pelo homem são incorporados a este ciclo por diferentes processos..
Poluentes químicos no ar são incorporados à chuva. Agroquímicos aplicados ao solo, sofrem lixiviação e infiltração em aquíferos, ou escorrem para rios, lagos e mares.
Também os resíduos de gorduras e óleos e os lixiviados dos aterros sanitários, são arrastados por infiltração para as águas subterrâneas.
Extração de abastecimento de água com cheque especial em recursos hídricos
Essas práticas de descoberto produzem esgotamento das reservas de água subterrânea e superficial, afetam os ecossistemas e produzem subsidência local do solo.
Química ambiental do solo
Os solos são um dos fatores mais importantes no equilíbrio da biosfera. Eles fornecem ancoragem, água e nutrientes para as plantas, que são produtoras nas cadeias tróficas terrestres.
O chão
O solo pode ser definido como um ecossistema complexo e dinâmico de três fases: uma fase sólida com suporte mineral e orgânico, uma fase líquida aquosa e uma fase gasosa; caracterizado por possuir uma fauna e flora particulares (bactérias, fungos, vírus, plantas, insetos, nematóides, protozoários).
As propriedades do solo são constantemente modificadas pelas condições ambientais e pela atividade biológica que nele ocorre..
Impactos antropológicos no solo
A degradação do solo é um processo que reduz a capacidade produtiva do solo, capaz de produzir uma mudança profunda e negativa no ecossistema..
Os fatores que produzem a degradação do solo são: clima, fisiografia, litologia, vegetação e ação humana.

Por ação humana pode ocorrer:
- Degradação física do solo (por exemplo, compactação de práticas agrícolas e pecuárias inadequadas).
- Degradação química do solo (acidificação, alcalinização, salinização, contaminação com agroquímicos, com efluentes da atividade industrial e urbana, derramamentos de óleo, entre outros).
- Degradação biológica do solo (diminuição do teor de matéria orgânica, degradação da cobertura vegetal, perda de microrganismos fixadores de nitrogênio, entre outros).
Relação químico-ambiente
A química ambiental estuda os diferentes processos químicos que ocorrem nos três compartimentos ambientais: atmosfera, hidrosfera e solo. É interessante revisar uma abordagem adicional em um modelo químico simples, que tenta explicar as transferências globais de matéria que ocorrem no meio ambiente..
-Modelo Garrels e Lerman
Garrels e Lerman (1981), desenvolveram um modelo simplificado da biogeoquímica da superfície terrestre, que estuda as interações entre os compartimentos atmosfera, hidrosfera, crosta terrestre e biosfera incluída..
O modelo Garrels e Lerman considera os sete principais minerais constituintes do planeta:
- Gesso (CaSO4)
- Pirita (FeSdois)
- Carbonato de cálcio (CaCO3)
- Carbonato de magnésio (MgCO3)
- Silicato de magnésio (MgSiO3)
- Óxido férrico (FedoisOU3)
- Dióxido de silício (SiOdois)
A matéria orgânica que constitui a biosfera (viva e morta), é representada como CHdoisOu qual é a composição estequiométrica aproximada de tecidos vivos.
No modelo de Garrels e Lerman, as mudanças geológicas são estudadas como transferências líquidas de matéria entre esses oito componentes do planeta, por meio de reações químicas e um balanço líquido de conservação de massa..
O acúmulo de COdois na atmosfera
Por exemplo, o problema do acúmulo de COdois na atmosfera é estudado neste modelo, dizendo que: estamos atualmente queimando o carbono orgânico armazenado na biosfera como carvão, petróleo e gás natural depositado no subsolo em tempos geológicos passados.
Como conseqüência dessa queima intensiva de combustíveis fósseis, a concentração de COdois atmosférico está aumentando.
Concentrações aumentadas de COdois na atmosfera terrestre se deve ao fato de que a taxa de combustão do carbono fóssil excede a taxa de absorção de carbono pelos outros componentes do sistema biogeoquímico terrestre (como os organismos fotossintéticos e a hidrosfera, por exemplo).
Desta forma, a emissão de COdois para a atmosfera devido às atividades humanas, contorna o sistema regulatório que modula as mudanças na Terra.
O tamanho da biosfera
O modelo desenvolvido por Garrels e Lerman também considera que o tamanho da biosfera aumenta e diminui como resultado do equilíbrio entre a fotossíntese e a respiração..
Durante a história da vida na Terra, a massa da biosfera aumentou em estágios com altas taxas de fotossíntese. Isso resultou em um armazenamento líquido de carbono orgânico e emissão de oxigênio:
COdois + HdoisO → CHdoisO + Odois
A respiração como uma atividade metabólica de microorganismos e animais superiores, converte o carbono orgânico de volta em dióxido de carbono (COdois) e água (HdoisO), ou seja, ele inverte a reação química anterior.
A presença de água, o armazenamento de carbono orgânico e a produção de oxigênio molecular são fundamentais para a existência de vida..
Aplicações de química ambiental
A química ambiental oferece soluções para a prevenção, mitigação e remediação de danos ambientais causados pela atividade humana. Entre algumas dessas soluções podemos citar:
- O design de novos materiais chamados MOF's (por sua sigla em Inglês: Estruturas Metálicas Orgânicas) Estes são muito porosos e têm a capacidade de: absorver e reter COdois, obter HdoisOu de vapor de ar do deserto e armazenamento Hdois em pequenos recipientes.
- A conversão de resíduos em matérias-primas. Por exemplo, o uso de pneus usados na produção de grama artificial ou sola de sapato. Também a utilização de resíduos da poda de lavouras, na geração de biogás ou bioetanol.
- Sínteses químicas de substitutos de CFC.
- O desenvolvimento de energias alternativas, como as células de hidrogênio, para a geração de eletricidade não poluente.
- Controle da poluição atmosférica, com filtros inertes e filtros reativos.
- Dessalinização de água do mar por osmose reversa.
- O desenvolvimento de novos materiais para a floculação de substâncias coloidais suspensas em água (processo de purificação).
- A reversão da eutrofização do lago.
- O desenvolvimento da "química verde", tendência que propõe a substituição de compostos químicos tóxicos por outros menos tóxicos, e de procedimentos químicos "ecológicos". Por exemplo, é aplicado no uso de solventes e matérias-primas menos tóxicas, na indústria, na lavagem a seco de lavanderias, entre outros..
Referências
- Calvert, J. G., Lazrus, A., Kok, G. L., Heikes, B. G., Walega, J. G., Lind, J. e Cantrell, C. A. (1985). Mecanismos químicos de geração de ácido na troposfera. Nature, 317 (6032), 27-35. doi: 10.1038 / 317027a0.
- Crutzen, P.J. (1970). A influência dos óxidos de nitrogênio no conteúdo atmosférico. Q.J.R. Metheorol. Soc. Wiley-Blackwell. 96: 320-325.
- Garrels, R.M. e Lerman, A. (1981). Ciclos fanerozóicos de carbono sedimentar e enxofre. Proceedings of the Natural Academy of Sciences. USOS. 78: 4.652-4.656.
- Hester, R. E. e Harrison, R. M. (2002). Mudança Ambiental Global. Royal Society of Chemistry. pp 205.
- Hites, R. A. (2007). Elementos de Química Ambiental. Wiley-Interscience. pp 215.
- Manahan, S.E. (2000). Química Ambiental. Sétima edição. CRC. pp 876
- Molina, M.J. e Rowland, F.S. (1974). Sumidouro estratosférico de clorofluorometanos: destruição do ozônio catalisada por átomo de cloro. Natureza. 249: 810-812.
- Morel, F.M. e Hering, J.M. (2000). Princípios e aplicações da química aquática. Nova York: John Wiley.
- Stockwell, W. R., Lawson, C. V., Saunders, E. e Goliff, W. S. (2011). Uma revisão da química atmosférica troposférica e dos mecanismos químicos da fase gasosa para modelagem da qualidade do ar. Atmosfera, 3 (1), 1-32. doi: 10,3390 / atmos3010001


Ainda sem comentários