
Propriedades, riscos e usos do cloreto de amônio (NH4Cl)
O cloreto de amônio, também conhecido como sal de amônia, é um sal inorgânico encontrado na urina, cuja fórmula é NH4Cl. É encontrado em formações mineralógicas e nesta forma é denominado sal de amônia. Também foi encontrado em algumas fontes vulcânicas e cinzas.
Ele pode ser obtido por vários métodos. A primeira é por meio da neutralização com HCl do resíduo de amônia formado na destilação do carvão: NH3 + HCl → NH4Cl.
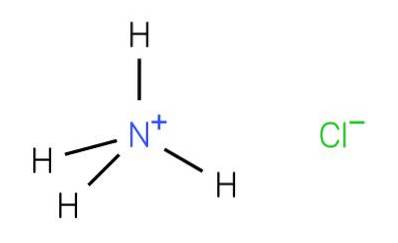
A segunda estratégia é através do processo Solvay para obter carbonato de sódio (ou bicarbonato) e onde o cloreto de amônio é produzido como subproduto:
NH3 + COdois + NaCl + HdoisO → NH4Cl + NaHCO3
No processo Solvay, o bicarbonato de sódio é recuperado por filtração e, em seguida, o cloreto de amônio que permanece em solução cristaliza (fórmula de cloreto de amônio, S.F.).
Mais de 230.000 toneladas de cloreto de amônio são produzidas anualmente no Japão, onde é usado principalmente para fertilizantes no cultivo de arroz..
No entanto, o sal inodoro tem muitas outras aplicações, incluindo o uso na fabricação de produtos de limpeza pessoal, pirotécnica, como um componente na indústria metalúrgica, medicina, como aromatizante na indústria de alimentos e como eletrólito em baterias de zinco. Chemical Company, 2016).
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 3 usos
- 3.1 1- Medicina
- 3.2 2- Fertilizante
- 3,3 3- Metalurgia
- 3.4 4- Componente da bateria
- 3,5 5- Alimentos
- 3,6 6- Outros usos
- 4 referências
Propriedades físicas e químicas
Cloreto de amônio são partículas brancas higroscópicas finamente divididas e inodoras (National Center for Biotechnology Information., 2017).

O composto tem uma estrutura de rede triclínica com uma estrutura cúbica centrada no centro. Seu peso molecular é 53,490 g / mol, sua densidade é 1,5274 g / mL e seus pontos de fusão e ebulição são 338 ºC e 520 ºC..
O cloreto de amônio é solúvel em água, podendo dissolver 383,0 g de composto por litro de solvente. Também é solúvel em etanol, metanol e glicerol e ligeiramente solúvel em acetona. É insolúvel em solventes orgânicos, como acetato de etila (Royal Society of Chemistry, 2015).
O cloreto de amônio pode sofrer diferentes reações de grande valor para as indústrias química e farmacêutica. Pode se decompor quando aquecido em ácido clorídrico e amônia:
NH4Cl → NH3 + HCl
Além disso, pode reagir com bases como hidróxido de sódio ou potássio para também produzir gás de amônia:
NH4Cl + NaOH → NH3 + NaCl + HdoisOU
Outra reação importante em que o cloreto de amônia é utilizado é a decomposição de carbonatos e bicarbonatos, formando um sal e amônia:
2NH4Cl + NadoisCO3 → 2 NaCl + COdois + HdoisO + 2NH3
O cloreto de amônio é considerado um sal ácido. As soluções resultantes contêm concentrações moderadas de íons hidrônio e têm um pH inferior a 7,0. Eles reagem como ácidos para neutralizar as bases.
Eles geralmente não reagem como agentes oxidantes ou agentes redutores, mas tal comportamento não é impossível. Muitos desses compostos catalisam reações orgânicas (cloreto de amônio, 2016).
Reatividade e perigos
O cloreto de amônio é extremamente venenoso e tóxico. Eles causam danos aos órgãos por ingestão ou exposição a longo prazo e também são prejudiciais aos olhos. Não é inflamável e não reage com outros produtos químicos (Instituto Nacional de Segurança e Saúde Ocupacional, 2014).
Em caso de contato com os olhos, verifique se está usando lentes de contato e remova-as imediatamente. Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Pomada para os olhos não deve ser usada.
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas próprias mãos e corpo.
Coloque a vítima sob um chuveiro de emergência. Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada é lavada delicadamente com água corrente e sabão não abrasivo. Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de usá-la novamente.
Se o contato com a pele for grave, deve-se lavar com sabonete desinfetante e cobrir a pele contaminada com creme antibacteriano..
Em caso de inalação, a vítima deve ser deixada repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata.
Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio. Se a vítima não estiver respirando, a ressuscitação boca a boca é realizada. Sempre tendo em mente que pode ser perigoso para a pessoa que está prestando socorro fazer reanimação boca a boca quando o material inalado for tóxico, infeccioso ou corrosivo..
Se ingerido, não induza o vômito. Afrouxe roupas apertadas, como golas de camisa, cintos ou gravatas. Se a vítima não estiver respirando, faça a ressuscitação boca-a-boca.
Em todos os casos, deve-se procurar atendimento médico imediato (Folha de Dados de Segurança do Material Cloreto de amônio, 2013).
Formulários
1- Remédio
O cloreto de amônio tem uma função bioquímica muito importante: mantém o pH fisiológico.
Como sal ácido, pode ajudar a corrigir situações em que a concentração plasmática de íons cloreto é baixa ou em casos de alcalose no sangue (pH sanguíneo elevado). Isso pode ocorrer após vômito, sucção (remoção) do conteúdo estomacal, uso de diuréticos (água ou comprimidos para líquidos) ou com certas doenças estomacais..
O cloreto de amônio também causa a eliminação do excesso de sais e água através do aumento da micção e causa acidose na urina (torna-a mais ácida)..
O cloreto de amônio também tem sido usado para reduzir o inchaço ou ganho de peso que ocorre antes dos períodos menstruais e como um auxílio no tratamento de infecções do trato urinário (University of Utah, 2017).
É um componente de muitos medicamentos para resfriado e tosse devido à sua eficácia como expectorante. Na medicina veterinária, é usado para prevenir cálculos urinários em cabras, bovinos e ovinos (Encyclopædia Britannica, 2016).
2- Fertilizante
O cloreto de amônio é utilizado principalmente como fonte de nitrogênio em fertilizantes (que corresponde a 90% da produção global do composto), como o fosfato de cloroamônio, principalmente nas lavouras de arroz e trigo na Ásia.
3- Metalurgia
O cloreto de amônio é usado como um fundente na preparação de metais para serem revestidos de estanho, galvanizados ou soldados. Funciona como um fluxo, limpando a superfície das peças de trabalho, reagindo com óxidos de metal na superfície para formar um cloreto de metal volátil.
Para isso, é vendido em blocos em lojas de ferragens para uso na limpeza da ponta de um ferro de soldar, podendo ser incluído na solda como fundente..
4- Componente da bateria
Cloreto de amônio, NH4Cl, é um componente de baterias de células secas, reservatórios de energia que alimentam dispositivos elétricos. As baterias permitem que você use eletricidade quando você não estiver perto de uma tomada elétrica.
Existem três componentes principais para cada bateria: um cátodo (a parte superior de sua bateria AA diária, de onde fluem os elétrons), um ânodo (a parte inferior da bateria AA, para onde os elétrons fluem) e um eletrólito através do qual elétrons e íons podem se mover.
Quando o cloreto de amônio é usado como eletrólito em uma bateria, ele se transforma em uma pasta aquosa e é colocado entre o cátodo e o ânodo..
As reações químicas entre os cátodos e os ânodos da bateria fazem com que os elétrons fluam através da pasta de cloreto de amônio, para longe do cátodo e em direção ao ânodo..
Os elétrons passam por contatos de metal no compartimento da bateria fazendo o equipamento elétrico funcionar (American Chemistry Council, Inc, 2005).
5- Alimentação
Em vários países, o cloreto de amônio, sob o nome de sal de amônia ou coloquialmente salmiakki, é usado como aditivo alimentar sob o número E E510, geralmente como um nutriente de levedura na produção de pão..
É um suplemento dietético para bovinos e um ingrediente em meios nutritivos para leveduras e muitos microorganismos..
O cloreto de amônio é usado para dar sabor a doces escuros chamados de alcaçuz salgado (muito popular nos países nórdicos), na panificação para dar aos biscoitos uma textura muito crocante e em licor Salmiakki Koskenkorva para dar sabor.
Na Índia e no Paquistão, é chamado de "Noshader" e é usado para realçar o frescor de petiscos como samosas e jalebi..
6- Outros usos
O cloreto de amônio pode ser encontrado em xampus, tinturas de cabelo e alvejantes, sabonetes e produtos de limpeza para o corpo, produtos de limpeza facial, condicionadores, saboneteira, bem como óleos e sais de banho..
O cloreto de amônio também é utilizado na corrosão na fabricação de circuitos impressos, como extintor de incêndio. É também um ingrediente em fogos de artifício, explosivos e fósforos e como agente de cura em adesivos à base de formaldeído..
Referências
- American Chemistry Council, Inc. (maio de 2005). Cloreto de amônio: ajudando a fornecer eletricidade portátil. Recuperado de americanchemistry: americanchemistry.com.
- Cloreto de amônio. (2016). Recuperado de CAMEO Chemicals: cameochemicals.noaa.gov.
- Fórmula de cloreto de amônio. (S.F.). Recuperado de softschools: softschools.com.
- EMBL-EBI. (2016, 29 de fevereiro). cloreto de amônio. Recuperado de ChEBI: ebi.ac.uk.
- Encyclopædia Britannica. (2016, 13 de abril). Cloreto de amônio (NH4Cl). Recuperado da Encyclopædia Britannica: britannica.com.
- Folha de dados de segurança do material Cloreto de amônio. (2013, 21 de maio). Recuperado do sciencelab: sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 22 de abril). PubChem Compound Database; CID = 25517. Recuperado do PubChem: pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Cloreto de amônio. Recuperado de chemspider: chemspider.com.
- The Chemical Company. (2016). Cloreto de amônio. Recuperado do thechemco: thechemco.com.
- O Instituto Nacional de Segurança e Saúde Ocupacional. (2014, 1º de julho). CLORETO DE AMÔNIO. Recuperado de cdc.gov.
- Universidade de Utah. (2017). Comprimidos com revestimento entérico de cloreto de amônio. RR recuperado de health.utah.edu.


Ainda sem comentários