
Propriedades coligativas (com fórmulas)
O propriedade coligativa é qualquer propriedade de uma substância que depende ou varia de acordo com o número de partículas presentes nela (na forma de moléculas ou átomos), sem depender da natureza dessas partículas.
Em outras palavras, eles também podem ser explicados como propriedades de soluções que dependem da relação entre o número de partículas de soluto e o número de partículas de solvente. Este conceito foi introduzido em 1891 pelo químico alemão Wilhelm Ostwald, que classificou as propriedades do soluto em três categorias.

Essas categorias proclamavam que as propriedades coligativas dependiam unicamente da concentração e da temperatura do soluto e não da natureza de suas partículas..
Além disso, as propriedades aditivas, como a massa, dependiam da composição do soluto, e as propriedades constitucionais dependiam mais da estrutura molecular do soluto..
Índice do artigo
- 1 propriedades coligativas
- 1.1 Diminuição da pressão de vapor
- 1.2 Aumentando a temperatura de ebulição
- 1.3 Reduzindo a temperatura de congelamento
- 1.4 Pressão osmótica
- 2 referências
Propriedades coligativas
As propriedades coligativas são estudadas principalmente para soluções diluídas (devido ao seu comportamento quase ideal), e são as seguintes:
Diminuição da pressão de vapor
Pode-se dizer que a pressão de vapor de um líquido é a pressão de equilíbrio das moléculas de vapor com as quais aquele líquido está em contato..
Da mesma forma, a relação dessas pressões é explicada com a lei de Raoult, que expressa que a pressão parcial de um componente é igual ao produto da fração molar do componente pela pressão de vapor do componente em seu estado puro:
PPARA = XPARA . PºPARA
Nesta expressão:
PPARA = Pressão de vapor parcial do componente A na mistura.
XPARA = Fração molar do componente A.
PºPARA= Pressão de vapor do componente A puro.
No caso de diminuição da pressão de vapor de um solvente, isso ocorre quando um soluto não volátil é adicionado a ele para formar uma solução. Como é conhecido e por definição, uma substância não volátil não tem tendência a evaporar.
Por esta razão, quanto mais deste soluto é adicionado ao solvente volátil, menor será a pressão de vapor e menos solvente pode escapar para se tornar um estado gasoso..
Assim, quando o solvente evapora naturalmente ou forçosamente, uma quantidade de solvente finalmente permanece sem evaporar junto com o soluto não volátil..
Esse fenômeno pode ser melhor explicado com o conceito de entropia: quando as moléculas fazem a transição da fase líquida para a fase gasosa, a entropia do sistema aumenta..
Isso significa que a entropia dessa fase gasosa será sempre maior que a do estado líquido, pois as moléculas do gás ocupam um volume maior..
Então, se a entropia do estado líquido aumenta por diluição, mesmo que esteja ligada a um soluto, a diferença entre os dois sistemas diminui. Por esse motivo, a diminuição da entropia também diminui a pressão de vapor..
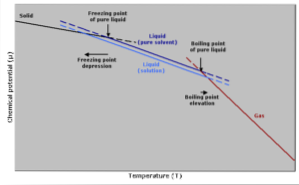
Aumento da temperatura de ebulição
O ponto de ebulição é aquela temperatura na qual há equilíbrio entre as fases líquida e gasosa. Nesse ponto, o número de moléculas de gás que se tornam líquidas (condensando) é igual ao número de moléculas de líquido que evaporam em gás..
A adição de um soluto faz com que a concentração de moléculas líquidas se dilua, fazendo com que a taxa de evaporação diminua. Isso gera uma mudança no ponto de ebulição, para compensar a mudança na concentração do solvente..
Em outras palavras mais simples, a temperatura de ebulição de uma solução é maior do que a do solvente em seu estado puro. Isso é expresso por uma expressão matemática mostrada abaixo:
ΔTb = i. Kb . m
Nesta expressão:
ΔTb = Tb (solução) - Tb (solvente) = Variação da temperatura de ebulição.
i = fator van't Hoff.
Kb = Constante de ebulição do solvente (0,512 ºC / molal para água).
m = Molalidade (mol / kg).
Redução da temperatura de congelamento
A temperatura de congelamento de um solvente puro diminuirá quando uma quantidade de soluto for adicionada, uma vez que é afetada pelo mesmo fenômeno que a pressão de vapor diminui..
Isso ocorre porque, ao diminuir a pressão de vapor do solvente pela diluição de um soluto, será necessária uma temperatura mais baixa para fazê-lo congelar..
A natureza do processo de congelamento também pode ser levada em consideração para explicar esse fenômeno: para um líquido congelar, ele deve atingir um estado ordenado no qual acaba formando cristais..
Se houver impurezas dentro do líquido na forma de solutos, o líquido será menos ordenado. Por isso, a solução terá maiores dificuldades de congelamento do que um solvente sem impurezas..
Essa redução é expressa como:
ΔTF = -i. KF . m
Na expressão acima:
ΔTF = TF (solução) - TF (solvente) = variação da temperatura de congelamento.
i = fator van't Hoff.
KF = Constante de congelamento do solvente (1,86 ºC kg / mol para água).
m = Molalidade (mol / kg).
Pressão osmótica
O processo conhecido como osmose é a tendência de um solvente passar por uma membrana semipermeável de uma solução para outra (ou de um solvente puro para uma solução).
Essa membrana representa uma barreira pela qual algumas substâncias podem passar e outras não, como no caso das membranas semipermeáveis nas paredes celulares de células animais e vegetais..
A pressão osmótica é então definida como a pressão mínima que deve ser aplicada a uma solução para interromper a passagem de seu solvente puro através de uma membrana semipermeável..
É também conhecido como a medida da tendência de uma solução em receber o solvente puro devido ao efeito da osmose. Esta propriedade é coligativa, pois depende da concentração de soluto na solução, que é expressa como uma expressão matemática:
Π. V = n. R. T, ou também π = M. R. T
Nessas expressões:
n = Número de moles de partículas na solução.
R = constante de gás universal (8,314472 J. K-1 . toupeira-1).
T = Temperatura em Kelvin.
M = molaridade.
Referências
- Wikipedia. (s.f.). Propriedades coligativas. Obtido em en.wikipedia.org
- BC. (s.f.). Propriedades coligativas. Recuperado de opentextbc.ca
- Bosma, W. B. (s.f.). Propriedades coligativas. Obtido em chemicalexplained.com
- Sparknotes. (s.f.). Propriedades coligativas. Recuperado de sparknotes.com
- University, F. S. (s.f.). Propriedades coligativas. Obtido em chem.fsu.edu



Ainda sem comentários