
Potenciômetro (medidor de pH) Para que serve e como funciona

UMA potenciômetro é o dispositivo utilizado para medir a diferença de potencial entre um eletrodo de trabalho e um de referência, quando ambos estão imersos em uma solução da qual se deseja determinar sua acidez ou basicidade, expressando-a como pH.
Dessa forma, a potenciometria refere-se ao método analítico usado para determinar a concentração de íons H.+ em uma substância que está em solução, por meio de um potenciômetro e dos dois eletrodos citados.

No caso do eletrodo de referência, ele possui um potencial conhecido, constante e estável, ao contrário do eletrodo de trabalho. O potencial que se desenvolve neste último eletrodo varia em proporção à concentração de íons H+ que estão na solução.
Este potencial também é muito influenciado pela temperatura na qual a medição é realizada..
Índice do artigo
- 1 Para que serve?
- 2 Como funciona?
- 2.1 Eletrodos
- 2.2 Calibrando um potenciômetro
- 3 referências
Para que serve?
Existem muitos processos realizados no campo industrial - como produção de medicamentos, processamento de alimentos e purificação de água - que são altamente sensíveis às variações dos níveis de pH. Por este motivo sua correta medição é tão importante.
Como mencionado anteriormente, o pH é um parâmetro usado para medir a acidez ou alcalinidade de uma solução que está na fase aquosa, por meio da análise da concentração de íons H.+ em solução. Então, o valor do pH é calculado pela seguinte equação:
pH = -log [H+]
Portanto, o potenciômetro é usado para medir o pH de uma substância em solução..
Quando o potenciômetro é conectado aos dois eletrodos imersos na solução a ser analisada, ele detecta a diferença de potencial entre o eletrodo de trabalho e o eletrodo de referência, amplificando este sinal e convertendo-o em um valor de pH usando a equação descrita acima..
Como funciona?
O funcionamento de um potenciômetro é baseado no mecanismo de uma célula eletroquímica, onde os íons H estão envolvidos+ na reação química da célula para determinar a concentração desses íons na solução e, desta forma, obter o pH do mesmo.
Quando se deseja medir o pH de uma solução por potenciometria, utiliza-se um potenciômetro e um eletrodo; o primeiro é o dispositivo que determina o pH, enquanto o segundo é baseado na combinação de um eletrodo de referência e um eletrodo de medição que é sensível a analitos.
Nesse sentido, é formado um circuito pelo qual a corrente elétrica flui entre os eletrodos e a solução, onde eles desempenham a função de uma bateria quando estão imersos na referida solução..
Desta forma, o potenciômetro é projetado para gerar uma tensão igual a zero (em milivolts) quando o pH for igual a sete; ou seja, neutro.
Da mesma forma, quando se registra um aumento nos valores potenciais (com números positivos) significa que há valores de pH mais baixos, e quando se observa uma diminuição - ou seja, um crescimento para números negativos - falamos em valores mais altos..
Eletrodos
O eletrodo de medição (ou trabalho) consiste em um dispositivo onde a reação em estudo (oxidação ou redução) ocorre.
Embora existam muitos tipos, geralmente é de vidro, consistindo de uma membrana de vidro muito fina que tem permeabilidade a íons H.+ do ambiente em que está.
Ao colocá-lo em uma solução com pH diferente do da solução presente na célula, é gerada uma diferença de potencial entre as duas faces da membrana e essa diferença pode ser registrada por meio de um eletrodo de referência..
Já o eletrodo de referência é um dispositivo que possui características de potencial estável e com valor conhecido, normalmente utilizado como ânodo na célula eletroquímica..
Um exemplo desse tipo de eletrodo é aquele constituído por um fio de prata, que é revestido com cloreto de prata e imerso em solução diluída de ácido clorídrico, ou o eletrodo de referência saturado com calomelano, como o mostrado na figura abaixo.
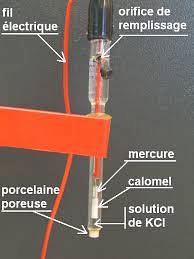
Assim, o potenciômetro determina a diferença de potencial que é gerada entre os eletrodos, embora apenas o potencial do eletrodo de trabalho dependa das concentrações das espécies iônicas..
Calibrando um potenciômetro
A calibração de um potenciômetro deve ser realizada através de soluções tampão conhecidas (também chamadas de tampões ou soluções tampão), que consistem em sistemas com pH praticamente invariável que contêm uma substância fraca e suas espécies conjugadas..
Cada tampão tem um pH específico, que pode ser ácido (pH<7), básico (pH>7) ou neutro (pH = 7), podendo ser adquiridos comercialmente já padronizados ou preparados em laboratório com reagentes certificados e utilizando procedimentos estabelecidos e validados..
Como os potenciômetros medem o valor do pH dentro de uma faixa considerada ampla, deve-se saber se o analito tem um pH maior ou menor que sete para proceder com sua calibração correta..
Assim, para amostras cujo pH se espera ser básico, deve-se calibrar com uma solução tampão com pH igual a sete e outra com pH superior (normalmente é usado um de pH dez)..
Por outro lado, para amostras com pH ácido esperado, ele é calibrado com uma solução tampão com pH igual a sete e outra com pH inferior (normalmente é usado um pH quatro)..
Finalmente, a recalibração deste instrumento de medição deve ser realizada antes e após cada uso, registrando seus resultados, incluindo a data e hora em que foram realizados e as características das soluções tampão utilizadas para controlá-lo..
Referências
- Wikipedia. (s.f.). medidor de pH. Obtido em es.wikipedia.org
- Chang, R. (2007). Química, nona edição. (McGraw-Hill).
- Westcott, C. (2012). Medições de pH. Obtido em books.google.co.ve
- Nielsen, C. (1996). Gerenciando o Laboratório Analítico: Puro e Simples. Obtido em books.google.co.ve
- Kenkel, J. (2010). Química analítica para técnicos, terceira edição. Obtido em books.google.co.ve
- Cable, M. (2005). Calibração: um guia técnico. Obtido em books.google.co.ve



Ainda sem comentários