
Estrutura, propriedades, usos, riscos do dissulfeto de carbono (CS2)
O dissulfeto de carbono É um composto formado pela união de um átomo de carbono (C) e dois átomos de enxofre (S). Sua fórmula química é CSdois. É um líquido incolor ou ligeiramente amarelado com um odor desagradável devido às impurezas que contém (compostos de enxofre). Quando puro, seu cheiro é suave e doce, semelhante ao clorofórmio ou éter..
Origina-se naturalmente da ação da luz solar sobre as moléculas orgânicas encontradas na água do mar. Além disso, é produzido em águas pantanosas e também expelido de vulcões junto com outros gases.
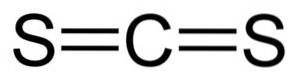
O dissulfeto de carbono é um líquido volátil e também altamente inflamável, portanto, deve ser mantido longe de chamas e faíscas ou dispositivos que possam produzi-los, até mesmo lâmpadas elétricas..
Tem a capacidade de dissolver um grande número de compostos, materiais e elementos, como fósforo, enxofre, selênio, resinas, lacas, etc. Portanto, ele encontra utilidade como um solvente.
É também um intermediário em várias reações químicas industriais, como a produção de rayon ou seda artificial..
Deve ser manuseado com cuidado e com instrumentos de proteção, pois é muito tóxico e perigoso.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão ou solidificação
- 3.4 Ponto de ebulição
- 3,5 ponto de fulgor
- 3.6 Temperatura de autoignição
- 3.7 Densidade
- 3.8 Pressão de vapor
- 3.9 Solubilidade
- 3.10 Propriedades químicas
- 4 Obtendo
- 4.1 Presença na natureza
- 5 usos
- 5.1 Na indústria química
- 5.2 Na produção de rayon e celofane
- 5.3 Na produção de tetracloreto de carbono
- 5.4 Em várias aplicações
- 5.5 Usos antigos
- 6 riscos
- 7 referências
Estrutura
O dissulfeto de carbono tem um átomo de carbono e dois átomos de enxofre em cada lado dele..
As ligações entre o átomo de carbono e os átomos de enxofre são covalentes e duplas, portanto muito fortes. A molécula CSdois tem uma estrutura linear e simétrica.

Nomenclatura
- Dissulfeto de carbono
- Dissulfeto de carbono
- Anidrido ditiocarbono
Propriedades
Estado físico
Líquido incolor a amarelado.
Peso molecular
76,15 g / mol
Ponto de fusão ou solidificação
-110,8 ° C
Ponto de ebulição
46,0 ºC
Ponto de inflamação
-30 ºC (método de copo fechado).
Temperatura de autoignição
90 ° C
Densidade
Líquido = 1,26 g / cm3 a 20 ºC.
Vapor = 2,67 vezes maior do que o ar.
Seus vapores são duas vezes mais pesados que o ar e o líquido é mais pesado que a água.
Pressão de vapor
279 mmHg a 25 ° C.
Esta é uma alta pressão de vapor.
Solubilidade
Muito ligeiramente solúvel em água: 2,16 g / L a 25 ° C. Solúvel em clorofórmio. Miscível com etanol, metanol, éter, benzeno, clorofórmio e tetracloreto de carbono.
Propriedades quimicas
O CSdois ele evapora facilmente à temperatura ambiente, pois seu ponto de ebulição é muito baixo e sua pressão de vapor é muito alta.
O dissulfeto de carbono é extremamente inflamável. Seus vapores se acendem com muita facilidade, mesmo com o calor de uma lâmpada elétrica. Isso significa que ele reage com o oxigênio muito rapidamente:
CSdois + 3 Odois → COdois + 2 SOdois
O fato de ter uma alta pressão de vapor em temperatura ambiente torna perigoso estar perto de uma chama.
Quando aquecido até a decomposição, pode explodir facilmente, emitindo gases tóxicos de óxido de enxofre. Acima de 90 ° C, ele se inflama espontaneamente.
Ele se decompõe quando armazenado por muito tempo. Ataca o cobre e suas ligas. Também reage com alguns plásticos, borrachas e revestimentos.
Reage sob certas condições com água, formando sulfeto de carbonila OCS, dióxido de carbono COdois e dissulfeto de hidrogênio HdoisS:
CSdois + HdoisO → OCS + HdoisS
CSdois + 2 hdoisO → COdois + 2 hdoisS
Com álcoois (ROH) em meio alcalino, forma xantatos (RO-CS-SNa):
CSdois + ROH + NaOH → HdoisO + RO-C (= S) -SNa
Obtendo
O dissulfeto de carbono é preparado comercialmente pela reação de enxofre com carbono. O processo é realizado a temperaturas de 750-900 ° C.
C + 2 S → CSdois
Em vez de carvão, também podem ser usados metano ou gás natural, e até mesmo etano, propano e propileno têm sido usados, caso em que a reação ocorre a 400-700 ° C com alto rendimento..
Também pode ser preparado pela reação de gás natural com sulfeto de hidrogênio HdoisS em temperatura muito alta.
Presença na natureza
O CSdois é um produto natural presente na atmosfera em quantidades muito pequenas (vestígios). É produzido fotoquimicamente em águas superficiais.
A ação da luz solar sobre certos compostos presentes na água do mar, como a cisteína (um aminoácido), leva à formação de dissulfeto de carbono.

Também é liberado naturalmente durante erupções vulcânicas e é encontrado em pequenas quantidades sobre pântanos..
Normalmente estamos expostos à respiração em proporções muito pequenas e está presente em alguns alimentos. Também é encontrado na fumaça do cigarro.
No meio ambiente é decomposto pela luz solar. No chão, ele se move através dele. Alguns microorganismos do solo o decompõem.
Formulários
Na industria quimica
O dissulfeto de carbono é um composto químico importante, pois é usado para preparar outros produtos químicos. Pode atuar como intermediário químico.
Também é usado como solvente de processo, por exemplo, para dissolver fósforo, enxofre, selênio, bromo, iodo, gorduras, resinas, ceras, lacas e gomas.
Permite a fabricação de fármacos e herbicidas, entre outros.
Na produção de rayon e celofane
Com o CSdois xantatos são preparados que são compostos usados na fabricação de rayon e celofane.
Para obter seda artificial ou rayon, utiliza-se celulose, que é tratada com álcali e dissulfeto de carbono CSdois e é transformado em xantato de celulose, solúvel em álcali. Esta solução é viscosa e por isso é chamada de "viscosa".
A viscose é forçada através de orifícios muito pequenos em um banho de ácido. Aqui, o xantato de celulose é transformado de volta em celulose que é insolúvel e fios longos e brilhantes são formados..
Os fios ou filamentos podem ser fiados em um material conhecido como rayon.
(1) Celulose + NaOH → Celulose alcalina
ROH + NaOH → RONa
(2) Álcalis-celulose + dissulfeto de carbono → xantato de celulose
RONa + S = C = S → RO-C (= S) -SNa
(3) Xantato de celulose + ácido → celulose (filamentos)
RO-C (= S) -SNa + Ácido → ROH

Se a celulose é precipitada pela passagem do xantato por uma fenda estreita, a celulose é regenerada na forma de folhas finas que compõem o celofane. Este é suavizado com glicerol e é usado como uma película protetora para objetos.

Na produção de tetracloreto de carbono
Dissulfeto de carbono reage com cloro Cldois para dar tetracloreto de carbono CCl4, que é um importante solvente não combustível.
CSdois + 3 Cldois → CCl4 + SdoisCldois
Em várias aplicações
O dissulfeto de carbono participa da vulcanização a frio de borrachas, atua como intermediário na fabricação de pesticidas e é utilizado para gerar catalisadores na indústria do petróleo e na fabricação de papel..
Xantatos preparados com CSdois são usados na flotação mineral.
Usos antigos
O CSdois é um veneno para organismos vivos. Anteriormente, era usado para destruir pragas como ratos, marmotas e formigas, despejando o líquido em qualquer espaço fechado em que esses animais vivessem (tocas e formigueiros).
Quando usados para este propósito, os vapores tóxicos densos destruíram qualquer organismo vivo que estivesse no espaço confinado..
Também era usado como anti-helmíntico para animais e para eliminar larvas de mosca varejeira do estômago de cavalos..
Na agricultura era utilizado como inseticida e nematicida, para fumigar o solo, para fumigação de viveiros, celeiros, silos e moinhos de cereais. Vagões ferroviários, navios e barcaças também foram pulverizados.

Todos esses usos foram proibidos devido à alta inflamabilidade e toxicidade do CSdois.
Riscos
O CSdois é altamente inflamável. Muitas de suas reações podem causar incêndio ou explosão. As misturas de seus vapores com o ar são explosivas. Quando inflamado, ele produz gases irritantes ou tóxicos.
O dissulfeto de carbono não deve ser despejado nos ralos, pois uma mistura de CS permanece nos tubosdois e ar que pode causar uma explosão se inflamado acidentalmente.
Seus vapores se inflamam espontaneamente em contato com faíscas ou superfícies quentes.
O dissulfeto de carbono irrita gravemente os olhos, a pele e as membranas mucosas.
Se inalado ou ingerido, afeta gravemente o sistema nervoso central, o sistema cardiovascular, os olhos, os rins e o fígado. Também pode ser absorvido pela pele, causando danos.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2020). Dissulfeto de carbono. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Mopper, K. e Kieber, D.J. (2002). Fotoquímica e Ciclagem de Carbono, Enxofre, Nitrogênio e Fósforo. In Biogeochemistry of Marine Dissolved Organic Matter. Recuperado de sciencedirect.com.
- Meyer, B. (1977). Usos Industriais do Enxofre e Seus Compostos. Dissulfeto de carbono. Em Enxofre, Energia e Meio Ambiente. Recuperado de sciencedirect.com.
- Pohanish, R.P. (2012). C. Dissulfeto de carbono. No Handbook of Toxic and Hazardous Chemicals and Carcinogens (Sexta Edição). Recuperado de sciencedirect.com.
- Morrison, R.T. e Boyd, R.N. (2002). Química orgânica. 6ª Edição. Prentice-Hall.
- Windholz, M. et al. (editores) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Décima edição. Merck & CO., Inc.



Ainda sem comentários