
Estrutura, usos, propriedades do citrato de sódio (C6H5O7Na3)
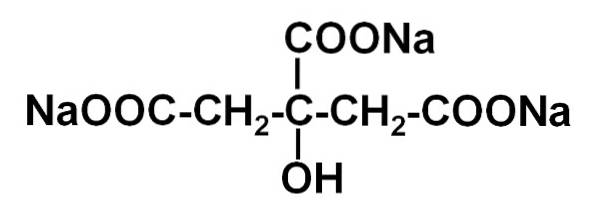
O citrato de sódio É o sal de sódio do ácido cítrico. É formado por um ânion citrato C6H5OU73- e três cátions de sódio+. Sua fórmula molecular é C6H5OU7N / D3 ou em sua forma expandida: NaOOC-CHdois-C (COONa) (OH) -CHdois-COONa. O citrato de sódio é a base conjugada do ácido cítrico, ou seja, é teoricamente obtido a partir deste substituindo cada próton H+ de -COOH para um Na sódico+.
Pode ser preparado na forma anidra (sem água em sua composição) ou na forma hidratada com 2 ou 5 moléculas de água. É um composto que quando anidro (sem água) tende a absorver água do meio ambiente.
O citrato de sódio atua como tampão, ou seja, estabiliza o pH, que é uma medida da acidez ou basicidade de uma solução aquosa. Ele também tem a propriedade de formar um composto estável com íons cálcio Ca.dois+, citrato de cálcio.
É usado na indústria de alimentos, por exemplo, para evitar que o leite de vaca forme caroços de difícil digestão para os bebês.
Em laboratórios de bioensaios, é usado para evitar que o sangue coletado de pacientes para certos testes coagule. Também evita a coagulação do sangue usado nas transfusões. É amplamente utilizado em detergentes sem fosfato porque não é poluente.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Solubilidade
- 3,5 pH
- 3.6 Propriedades químicas
- 3.7 Outras propriedades
- 4 Obtendo
- 4.1 Localização na natureza
- 5 usos
- 5.1 Na indústria de alimentos
- 5.2 Na medicina
- 5.3 Na indústria farmacêutica
- 5.4 Em exames de sangue
- 5.5 Na síntese de nanopartículas
- 5.6 Em detergentes ecológicos
- 5.7 Na melhoria da exploração das areias betuminosas
- 5.8 Em outras aplicações
- 6 referências
Estrutura
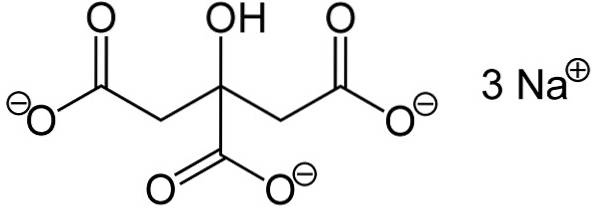
O citrato trissódico é composto por três íons sódio Na+ e um íon citrato.
O íon citrato é composto por uma cadeia de três átomos de carbono aos quais 3 carboxilatos estão ligados -COO- (um para cada átomo de carbono) e um hidroxil-OH no carbono central.
Cada um dos 3 íons de Na+ está ligado a um grupo -COO-.
Nomenclatura
- Citrato de sódio
- Citrato trissódico
- 2-hidroxipropano-1,2,3-tricarboxilato trissódico
Propriedades
Estado físico
Sólido cristalino branco ou incolor.
Peso molecular
258,07 g / mol
Ponto de fusão
300 ºC
Solubilidade
É muito solúvel em água: 42,5 g / 100 mL a 25 ºC. É praticamente insolúvel em álcool.
pH
Uma solução aquosa de citrato de sódio a 5% possui um pH entre 7,5 e 9,0, ou seja, é ligeiramente alcalina.
Propriedades quimicas
O citrato de sódio é um tampão, o que significa que estabiliza o pH, que é uma medida da acidez ou alcalinidade de uma solução aquosa. O citrato, ao estabilizar o pH, não permite que a solução acidifique ou alcalinize acima de certos valores.
Quando há excesso de prótons H+ leva-os a converter seus grupos -COO- em grupos -COOH. Vice-versa, se houver muitos grupos OH- desiste dos prótons de seus grupos -COOH e os converte em -COO-.
Quando é transformado pelo corpo, fornece 3 moléculas de HCO3- para cada molécula de citrato.
Outras propriedades
Seus cristais são deliquescentes, ou seja, absorvem água do ar. O citrato de sódio di-hidratado é mais estável ao ar.
Se o diidrato for aquecido, ao atingir 150 ºC torna-se anidro (sem água).
Como o ácido cítrico, o citrato de sódio tem gosto azedo.
Obtendo
O citrato de sódio é geralmente feito adicionando carbonato de sódio a uma solução de ácido cítrico até que cesse a efervescência. A efervescência se deve à evolução do dióxido de carbono COdois:
N / DdoisCO3 + Ácido cítrico → Citrato de sódio + COdois↑
Em seguida, a água é evaporada da solução para cristalizar o produto.
Também pode ser preparado tratando uma solução de sulfato de sódio com citrato de cálcio:
N / DdoisSW4 + Citrato de cálcio → Citrato de sódio + CaSO4↓
A solução é filtrada para remover o CaSO4 sólido que precipitou. Em seguida, a solução é concentrada e, assim, o citrato de sódio cristaliza.
Localização na natureza
O citrato de sódio é a base conjugada do ácido cítrico, que é um composto natural encontrado em todos os organismos vivos, pois faz parte do seu metabolismo, que é o mecanismo de desenvolvimento de energia nas células..
Formulários
Na industria alimentícia
O citrato de sódio tem várias utilizações na indústria alimentar, por exemplo, como regulador de acidez, sequestrante, estabilizador, surfactante ou emulsionante..
É utilizado em bebidas, sobremesas congeladas e queijos especiais, entre outros produtos.
Permite evitar a coagulação do leite, por isso é adicionado ao leite de vaca que é utilizado na alimentação das crianças lactantes. Desta forma, coágulos ou coalhada dura de difícil digestão não são criados pelo estômago das crianças..

É utilizado para acelerar a fixação da cor em carne de porco ou vaca curada, ou seja, carnes que foram tratadas para evitar que se deteriorem. Até 50% de ácido ascórbico é substituído nestes.

Também é usado para prevenir a coagulação do sangue em carne fresca (como bifes).
Em medicina
É usado como agente alcalinizante, pois neutraliza o excesso de ácido no sangue e na urina. É indicado para tratar a acidose metabólica que ocorre quando o corpo produz muito ácido.
Uma vez ingerido, o íon citrato torna-se íon bicarbonato, que é um agente alcalinizante sistêmico (ou seja, de todo o organismo) e, como consequência, os íons H são neutralizados.+, aumenta o pH do sangue e reverte ou elimina a acidose.
O citrato de sódio serve como um agente neutralizante para dores de estômago.
É usado como expectorante e sudorífico. Possui ação diurética. Aumenta a excreção urinária de cálcio, por isso é usado na hipercalcemia, que é quando há excesso de cálcio no sangue.
Também serve para facilitar a remoção do chumbo quando ocorre envenenamento por chumbo..
Se administrado em excesso, pode causar alcalose, espasmos musculares devido ao mau funcionamento da glândula paratireóide e depressão da função cardíaca devido à diminuição do nível de cálcio no sangue, entre outros sintomas..
O citrato de sódio é usado em transfusões. É adicionado ao sangue junto com a dextrose para prevenir a coagulação.
Normalmente o fígado metaboliza rapidamente o citrato obtido na transfusão, entretanto, durante transfusões de grandes quantidades, a capacidade do fígado pode ser excedida..
Nesses casos, como o citrato forma um complexo com o cálcio, ocorre uma diminuição no íon cálcio Ca.dois+ No Sangue. Isso pode causar tontura, tremores, formigamento, etc. Portanto, as transfusões devem ser realizadas lentamente.
Na industria farmacêutica
Entre muitos outros usos, é usado para prevenir o escurecimento de drogas que contenham ferro e taninos..
Em exames de sangue
É utilizado como anticoagulante na coleta de sangue ou quando deve ser armazenado, pois atua como quelante de íons cálcio Cadois+, ou seja, ele se liga aos íons de cálcio formando citrato de cálcio que não é ionizado.
É usado em testes de coagulação e na determinação da taxa de sedimentação de glóbulos vermelhos..
É usado como anticoagulante durante a plasmaférese, um procedimento para remover do sangue o excesso de substâncias prejudiciais ao corpo..
Na síntese de nanopartículas
É utilizado como estabilizador na síntese de nanopartículas de ouro. Citrato trissódico di-hidratado é adicionado ao ácido cloroáurico, formando uma suspensão cor de vinho..
O citrato de sódio atua como agente redutor e antiplaquetário, pois se adsorve às nanopartículas..
Devido à carga negativa do citrato, as partículas se repelem evitando a aglomeração e formando uma dispersão estável. Quanto maior for a concentração de citrato, menores serão as partículas..
Essas nanopartículas são usadas para preparar biossensores médicos.
Em detergentes ecológicos
O citrato de sódio é amplamente utilizado em detergentes líquidos sem fosfato. Isso ocorre porque seu comportamento ambiental é inofensivo, pois é um metabólito encontrado em todos os organismos vivos..
É facilmente biodegradável e fracamente tóxico para a vida aquática. Por isso é considerado um agente de limpeza com características ecologicamente favoráveis..
Na melhoria da exploração das areias betuminosas
As areias betuminosas são formações arenosas ricas em betume ou alcatrão, um material semelhante ao petróleo.
Citrato de sódio foi testado com sucesso em conjunto com hidróxido de sódio NaOH para extrair óleo de areias betuminosas.
Pensa-se que ao juntar o citrato com o arenito, os iões -COO- O citrato forma um grande número de cargas negativas nas partículas de sílica. Isso produz uma melhor separação da areia do betume pela simples repelência das cargas negativas do cascalho das cargas negativas do betume.
Em outros aplicativos
É usado em fotografia, para remover vestígios de metais, em galvanoplastia e para remover SOdois gases residuais.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Citrato de sódio. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Coleta e Manuseio de Sangue. Em Dacie e Lewis Practical Hematology (décima segunda edição). Recuperado de sciencedirect.com.
- Steber, J. (2007). A ecotoxicidade dos ingredientes dos produtos de limpeza. No Manual de Limpeza / Descontaminação de Superfícies. Recuperado de sciencedirect.com.
- Xiang, B. et al. (2019). Estudo do papel do citrato de sódio na liberação do betume. Energy Fuels 2019, 33, 8271-8278. Recuperado de pubs.acs.org.
- Heddle, N. e Webert, K.E. (2007). Transfusion Medicine. Em Blood Banking and Transfusion Medicine (segunda edição). Recuperado de sciencedirect.com.
- Sudhakar, S. e Santhosh, P.B. (2017). Nanomateriais de ouro. In Advances in Biomembranes and Lipid Self-Assembly. Recuperado de sciencedirect.com.
- Elsevier (editorial) (2018). Capítulo 8. Nanometal. Em Fundamentos e Aplicações do Nano Silício em Plasmônicos e Fulerinos. Tendências atuais e futuras Micro e nanotecnologias. Páginas 169-203. Recuperado de sciencedirect.com.



Ainda sem comentários