
Estrutura do ácido sulfuroso, propriedades, nomenclatura, usos
O ácido sulfuroso é um oxácido que é formado pela dissolução do dióxido de enxofre, SOdois, na água. É um ácido inorgânico fraco e instável, que não foi detectado em solução, pois a reação de sua formação é reversível e o ácido se decompõe rapidamente nos reagentes que o produziram (SOdois e HdoisOU).
A molécula de ácido sulfuroso até agora só foi detectada na fase gasosa. As bases conjugadas deste ácido são ânions comuns nas formas de sulfitos e bissulfitos..
SWdois + HdoisOU <=> HSO3- + H+
Isso indica que usando o espectro Raman não é possível detectar a presença de ácido sulfuroso em uma solução de dióxido de enxofre em água..
Quando exposto à atmosfera, rapidamente se transforma em ácido sulfúrico. O ácido sulfúrico é reduzido a sulfeto de hidrogênio pela ação do ácido sulfúrico diluído e do zinco.
A tentativa de concentrar uma solução de sistema operacionaldois por evaporação da água para obter ácido sulfuroso livre de água, não produziu resultados, uma vez que o ácido se decompõe rapidamente (revertendo a reação de formação), então o ácido não pode ser isolado.
Índice do artigo
- 1 formação natural
- 2 Estrutura
- 2.1 Molécula isolada
- 2.2 Molécula cercada por água
- 2,3 SO2 ∙ nH2O
- 3 Propriedades físicas e químicas
- 3.1 Fórmula molecular
- 3.2 Peso molecular
- 3.3 Aparência física
- 3.4 Densidade
- 3,5 Densidade de vapor
- 3.6 Corrosividade
- 3.7 Solubilidade em água
- 3.8 Sensibilidade
- 3.9 Estabilidade
- 3,10 constante de acidez (Ka)
- 3,11 pKa
- 3,12 pH
- 3.13 Ponto de fulgor
- 3.14 Decomposição
- 4 Nomenclatura
- 5 Síntese
- 6 usos
- 6.1 Na floresta
- 6.2 Agente desinfetante e branqueador
- 6.3 Agente conservante
- 6.4 Outros usos
- 7 referências
Formação natural
O ácido sulfuroso é formado na natureza pela combinação do dióxido de enxofre, produto da atividade de grandes fábricas, com a água atmosférica. Por esse motivo, é considerada um produto intermediário da chuva ácida, causando grandes prejuízos à agricultura e ao meio ambiente..
Sua forma ácida não é utilizável na natureza, mas geralmente é preparada em seus sais, sulfito e bissulfito de sódio e potássio..
O sulfito é gerado endogenamente no corpo como resultado do metabolismo dos aminoácidos contendo enxofre. Da mesma forma, o sulfito é produzido como produto da fermentação de alimentos e bebidas. O sulfito é alergênico, neurotóxico e metabólico. É metabolizado pela enzima sulfito oxidase que o converte em sulfato, um composto inofensivo.
Estrutura
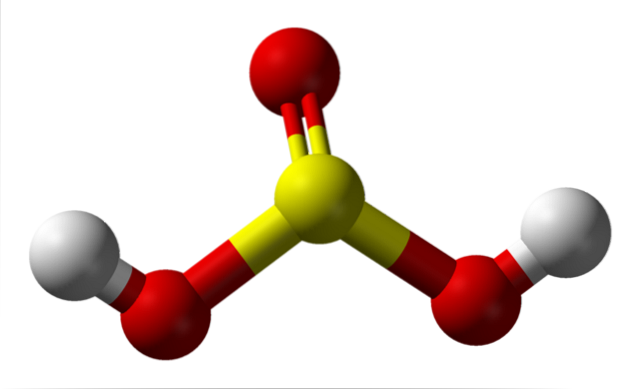
Molécula isolada
Na imagem você pode ver a estrutura de uma molécula isolada de ácido sulfuroso no estado gasoso. A esfera amarela no centro corresponde ao átomo de enxofre, as vermelhas aos átomos de oxigênio e as brancas aos hidrogênios. Sua geometria molecular em torno do átomo S é uma pirâmide trigonal, com os átomos O desenhando a base.
Então, no estado gasoso, as moléculas de HdoisSW3 pode ser pensado como minúsculas pirâmides trigonais flutuando no ar, supondo que seja estável o suficiente para durar um tempo sem reagir.
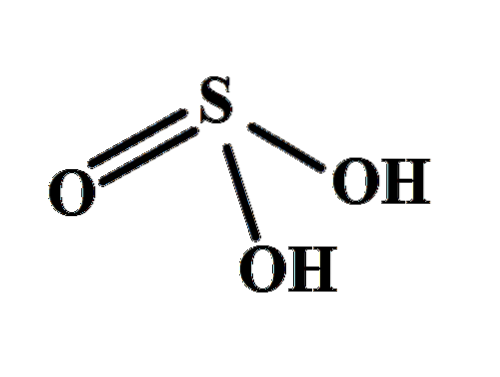
A estrutura deixa claro de onde vêm os dois hidrogênios ácidos: dos grupos hidroxila ligados por enxofre, HO-SO-OH. Portanto, para este composto, não é correto assumir que um dos prótons ácidos, H+, é liberado do átomo de enxofre, H-SOdois(OH).
Os dois grupos OH permitem que o ácido sulfuroso interaja através de ligações de hidrogênio e, além disso, o oxigênio da ligação S = O é um aceitador de hidrogênio, que converte HdoisSW3 um bom doador e aceitador dessas pontes.
De acordo com o acima, o HdoisSW3 deve ser capaz de se condensar em um líquido, assim como o ácido sulfúrico, HdoisSW4. No entanto, não é assim que acontece.
Molécula rodeada de água
Até o momento, não foi possível obter ácido sulfuroso anidro, ou seja, HdoisSW3(eu); enquanto o HdoisSW4(ac), por outro lado, após a desidratação, transforma-se em sua forma anidra, HdoisSW4(l), que é um líquido denso e viscoso.
Se for assumido que a molécula de HdoisSW3 permanece inalterado, então será capaz de se dissolver em grande parte na água. As interações que governariam nas ditas soluções aquosas seriam novamente ligações de hidrogênio; No entanto, as interações eletrostáticas também existiriam como resultado do equilíbrio de hidrólise:
HdoisSW3(ac) + HdoisO (l) <=> HSO3-(ac) + H3OU+(ac)
HSO3-(ac) + HdoisO (l) <=> SW3dois-(ac) + H3OU+
O íon sulfito, SO3dois- Seria a mesma molécula acima, mas sem as esferas brancas; e o íon sulfito de hidrogênio (ou bissulfito), HSO3-, retém uma esfera branca. Infinidades de sais podem surgir de ambos os ânions, alguns mais instáveis do que outros.
Na realidade, foi confirmado que uma porção extremamente pequena das soluções consiste em HdoisSW3; ou seja, a molécula explicada não é aquela que interage diretamente com as moléculas de água. A razão para isso é porque ele sofre decomposição causando SOdois e HdoisOu, que é termodinamicamente favorecido.
SWdois∙nHdoisOU
A verdadeira estrutura do ácido sulfuroso consiste em uma molécula de dióxido de enxofre circundada por uma esfera de água composta por n moléculas..
Assim, o SOdois, cuja estrutura é angular (tipo bumerangue), junto com sua esfera aquosa, é responsável pelos prótons ácidos que caracterizam a acidez:
SWdois∙ nHdoisO (ac) + HdoisO (l) <=> H3OU+(ac) + HSO3-(ac) + nHdoisO (l)
HSO3-(ac) + HdoisO (l) <=> SW3dois-(ac) + H3OU+
Além desse equilíbrio, há também um equilíbrio de solubilidade para SOdois, cuja molécula pode escapar da água para a fase gasosa:
SWdois(g) <=> SWdois(ac)
Propriedades físicas e químicas
Fórmula molecular
HdoisSW3
Peso molecular
82,073 g / mol.
Aspecto físico
É um líquido incolor, com cheiro forte de enxofre.
Densidade
1,03 g / ml.
Densidade do vapor
2.3 (em relação ao ar tomado como 1)
Corrosividade
É corrosivo para metais e tecidos.
Solubilidade em água
Miscível com água.
Sensibilidade
É sensível ao ar.
Estabilidade
Estável, mas incompatível com bases fortes.
Constante de acidez (Ka)
1,54 x 10-dois
pKa
1,81
pH
1,5 na escala de pH.
ponto de ignição
Não inflamável.
Decomposição
Quando aquecido, o ácido sulfuroso pode se decompor, emitindo uma fumaça tóxica de óxido de enxofre..
Nomenclatura
O enxofre tem as seguintes valências: ± 2, +4 e +6. Da fórmula HdoisSW3, a valência ou o número de oxidação do enxofre no composto pode ser calculado. Para fazer isso, basta resolver uma soma algébrica:
2 (+1) + 1v + 3 (-2) = 0
Por se tratar de um composto neutro, a soma das cargas dos átomos que o constituem deve ser 0. Resolvendo para v para a equação anterior, temos:
v = (6-2) / 1
Portanto, v é igual a +4. Ou seja, o enxofre participa com sua segunda valência e, de acordo com a nomenclatura tradicional, o sufixo -oso deve ser adicionado ao nome. Por este motivo em HdoisSW3 é conhecido como ácido sulfúricosuportar.
Outra maneira mais rápida de determinar esta valência é comparando o HdoisSW3 com o HdoisSW4. No HdoisSW4 o enxofre tem uma valência de +6, portanto, se um O for removido, a valência cai para +4; e se outro for removido, a valência cai para +2 (o que seria o caso do ácido soluçoenxofresuportar, HdoisSWdois).
Embora menos conhecido, para o HdoisSW3 Também pode ser denominado ácido trioxossulfúrico (IV), de acordo com a nomenclatura de estoque.
Síntese
Tecnicamente, é formado pela queima de enxofre para formar dióxido de enxofre. Este então se dissolve em água para formar ácido sulfuroso. No entanto, a reação é reversível e o ácido se decompõe rapidamente de volta aos reagentes..
Esta é uma explicação de porque o ácido sulfuroso não é encontrado em solução aquosa (como já mencionado na seção sobre sua estrutura química).
Formulários

Geralmente, os usos e aplicações do ácido sulfúrico, uma vez que sua presença não pode ser detectada, referem-se aos usos e aplicações de soluções de dióxido de enxofre e às bases e sais do ácido..
Na floresta
No processo de sulfito, a polpa de madeira é produzida na forma de fibras de celulose quase puras. Vários sais de ácido sulfuroso são usados para extrair lignina de cavacos de madeira, usando recipientes de alta pressão chamados digistores..
Os sais utilizados no processo de obtenção da polpa da madeira são o sulfito (SO3dois-) ou bissulfito (HSO3-), dependendo do pH. O contra-íon pode ser Na+, ACdois+, K+ ou NH4+.
Agente desinfetante e branqueador
-O ácido sulfuroso é usado como desinfetante. Ele também é usado como um agente de branqueamento suave, especialmente para materiais sensíveis ao cloro. Além disso, é utilizado como clareador dentário e aditivo alimentar.
-É um ingrediente em vários cosméticos para a pele e foi usado como um elemento pesticida na eliminação de ratos. Elimina manchas causadas por vinho ou frutas em diferentes tecidos.
-Atua como anti-séptico, sendo eficaz na prevenção de infecções cutâneas. Em alguns momentos, foi utilizado em fumigações para desinfetar navios, pertences de enfermos vítimas de epidemias, etc..
Agente conservante
O ácido sulfuroso é utilizado como conservante de frutas e vegetais e para prevenir a fermentação de bebidas como vinho e cerveja, sendo um elemento antioxidante, antibacteriano e fungicida..
Outros usos
-O ácido sulfuroso é usado na síntese de drogas e produtos químicos; na produção de vinho e cerveja; refino de produtos petrolíferos; e é usado como um reagente analítico.
-O bissulfito reage com os nucleosídeos da pirimidina e se soma à ligação dupla entre as posições 5 e 6 da pirimidina, modificando a ligação. A transformação de bissulfito é usada para testar estruturas secundárias ou superiores de polinucleotídeos.
Referências
- Wikipedia. (2018). Ácido sulfuroso. Recuperado de: en.wikipedia.org
- Nomenclatura de ácidos. [PDF]. Recuperado de: 2.chemistry.gatech.edu
- Voegele F. Andreas & col. (2002). Sobre a estabilidade do ácido sulfuroso (HdoisSW3) e seu dímero. Chem. Eur. J. 2002. 8, No.24.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição., P. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Formulação de química inorgânica. [PDF]. Recuperado de: ugr.es
- PubChem. (2018). Ácido sulfuroso. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15 de agosto de 2008). Oxiácido. Encyclopædia Britannica. Recuperado de: britannica.com



Ainda sem comentários