
Propriedades, riscos e usos do ácido brômico (HBrO3)
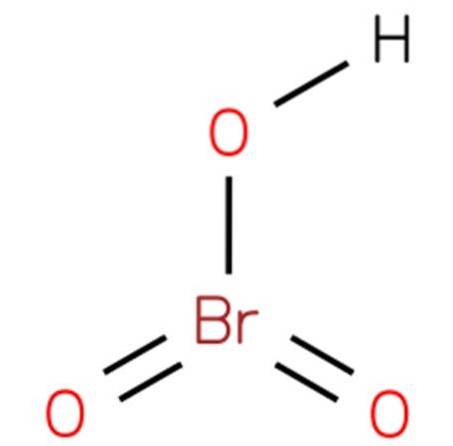
O ácido brômico, Também conhecido como bromato de hidrogênio ou ácido brômico (V), é um composto químico com a fórmula HBrO3. É um oxácido de bromo com estrutura análoga ao ácido clórico (EMBL-EBI, 2014). O composto é um ácido muito forte. Sua estrutura é apresentada na figura 1 (EMBL-EBI, 2008).
Para preparar o ácido brômico, um bromato solúvel é geralmente dissolvido em água e um sal de bário solúvel é adicionado. Precipitados de bromato de bário pouco solúveis.
O bromato de bário pode então ser dissolvido em água e acidificado com ácido sulfúrico para precipitar o sulfato de bário basicamente insolúvel e deixar o ácido brômico para trás (veja a imagem acima):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
O composto também pode ser produzido por decomposição de pentacloreto de bromo em solução alcalina de acordo com a reação:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
O ácido brômico é um forte agente oxidante. O íon bromato pode ser posteriormente oxidado com flúor elementar ou difluoreto de xenônio na presença de base, oxidação acompanhada por pequenas explosões e o tubo de Teflon pegando fogo (My Favorite Chemicals, S.F.).
Índice do artigo
- 1 Propriedades físicas e químicas do ácido brômico
- 2 Reatividade e perigos
- 2.1 Em caso de contato com os olhos
- 2.2 Em caso de contato com a pele
- 2.3 Em caso de inalação
- 3 usos
- 4 referências
Propriedades físicas e químicas do ácido brômico
O ácido brômico existe apenas em solução incolor (até 50% p / v) que fica amarelada em contato com o ar (National Center for Biotechnology Information., 2017). Sua aparência é mostrada na figura 2.

O composto tem um peso molecular de 128,91 g / mol e se decompõe a 100 ° C e tem um pKa de -2. Por ser um composto instável, suas propriedades físico-químicas foram obtidas por meio de cálculos computacionais..
Tem um ponto de fusão de 206,04 ° C, um ponto de ebulição de 517,26 ° C e uma solubilidade em água de 1 x 106 mg / l a 25 ° C (Royal Society of Chemistry, 2015).
O composto é um forte agente oxidante. Quando misturado com etanol ou éter, ele se decompõe para formar ácido acético em uma reação exotérmica. É essencial para a elaboração de sais bromato (BrO3-) que são preparados pela reação de carbonatos ou óxidos metálicos com ácido brômico (Watts, 1870).
Reatividade e perigos
O ácido brômico é um composto instável que se decompõe em bromo elementar. Por ser um ácido forte, é extremamente perigoso em caso de contato com a pele (corrosivo e irritante), em contato com os olhos (irritante) e em caso de ingestão. Muito perigoso também, em caso de inalação.
A superexposição severa pode causar danos aos pulmões, sufocação, perda de consciência ou morte. A exposição prolongada pode causar queimaduras e ulcerações na pele. A superexposição por inalação pode causar irritação respiratória..
A inflamação do olho é caracterizada por vermelhidão, lacrimejamento e coceira. A inflamação da pele é caracterizada por coceira, descamação, vermelhidão e, ocasionalmente, bolhas.
A substância é tóxica para os rins, pulmões e membranas mucosas. A exposição repetida ou prolongada à substância pode causar danos a esses órgãos..
Em caso de contato com os olhos
Verifique se as lentes de contato estão sendo usadas e remova-as imediatamente. Os olhos devem ser enxaguados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada. Pomada para os olhos não deve ser usada.
Em caso de contato com a pele
Se o produto químico entrar em contato com a roupa, remova-o o mais rápido possível, protegendo suas mãos e corpo. Coloque a vítima sob um chuveiro de emergência.
Se o produto químico se acumular na pele exposta da vítima, como nas mãos, a pele contaminada deve ser lavada com cuidado e cuidado com água corrente e sabão não abrasivo. Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave a roupa contaminada antes de usá-la novamente.
Se o contato com a pele for grave, deve-se lavar com sabonete desinfetante e cobrir a pele contaminada com creme antibacteriano..
Em caso de inalação
É aconselhável deixar a vítima repousar em área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata. Se a vítima tiver dificuldade para respirar, deve-se administrar oxigênio.
Se a vítima não estiver respirando, a ressuscitação boca a boca é realizada. Sempre tendo em mente que pode ser perigoso para a pessoa que está prestando socorro fazer reanimação boca a boca quando o material inalado for tóxico, infeccioso ou corrosivo..
Se ingerido, não induza o vômito. Afrouxe roupas apertadas, como golas de camisa, cintos ou gravatas. Se a vítima não estiver respirando, faça a ressuscitação boca a boca.
Em todos os casos, procure atendimento médico imediatamente..
Formulários
O ácido brômico é usado como um poderoso agente oxidante em reações laboratoriais. É utilizado para a produção de compostos químicos como iodatos, ácido clórico, ácido tetraiônico, entre outros..
Também é utilizado para a produção de bromatos como bromato de ferro, chumbo, manganês e mercúrio, entre outros..
O ácido brômico atua como um importante intermediário na reação de Bélousov-Zhabotinsky (Morris, 2010). Esta reação é um exemplo de relógios químicos e ilustra uma reação termodinâmica de não equilíbrio.
A reação de oscilação é catalisada pelo cério e está inerentemente conectada à química dos oxoácidos de bromo HBrOx. O crescente interesse em sistemas químicos não lineares forneceu fortes incentivos para estudar a química do bromo..
Na reação de Belousov-Zhabotinsky, os compostos de bromo envolvidos são o ácido hipobromoso HOBr, o ácido bromo HOBrO e o ácido brômico HBrO3 (3) (Rainer Glaser, 2013).
Esses tipos de reações são importantes para a química teórica. Eles mostram que as reações químicas não precisam ser dominadas pelo comportamento termodinâmico de equilíbrio.
Referências
- Ácido brômico. (S.F.). Recuperado de chemyq.com.
- EMBL-EBI. (16 de maio de 2008). ácido brômico. Recuperado de ebi.ac.uk.
- EMBL-EBI. (2014, 28 de julho). ácido clórico. Recuperado de ebi.ac.uk.
- Morris, S. (2010, 23 de janeiro). Reação de Belousov Zhabotinsky 8 x velocidade normal. Recuperado da youtubecom.
- Meus produtos químicos favoritos. (S.F.). Recuperado de bromicacid.com.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 11 de março). PubChem Compound Database; CID = 24445 ,. Obtido em PubChem.
- Rainer Glaser, M. D. (2013). Por que a acidez do ácido brômico é realmente importante para os modelos cinéticos de reações químicas oscilantes de Belousov-Zhabotinsky. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Ácido brômico. Recuperado de chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volume 1. London: longmans, green and co.

Ainda sem comentários