
O que são orbitais degenerados?
O orbitais degenerados eles são todos aqueles que estão no mesmo nível de energia. De acordo com esta definição, eles devem ter o mesmo número quântico principal n. Assim, os orbitais 2s e 2p são degenerados, pois pertencem ao nível de energia 2. Porém, sabe-se que suas funções de onda angular e radial são diferentes..
Como os valores de n, os elétrons começam a ocupar outros subníveis de energia, como os orbitais d e f. Cada um desses orbitais tem suas próprias características, que à primeira vista podem ser vistas em suas formas angulares; Estas são as figuras esféricas (s), halteres (p), trevo (d) e globulares (f).
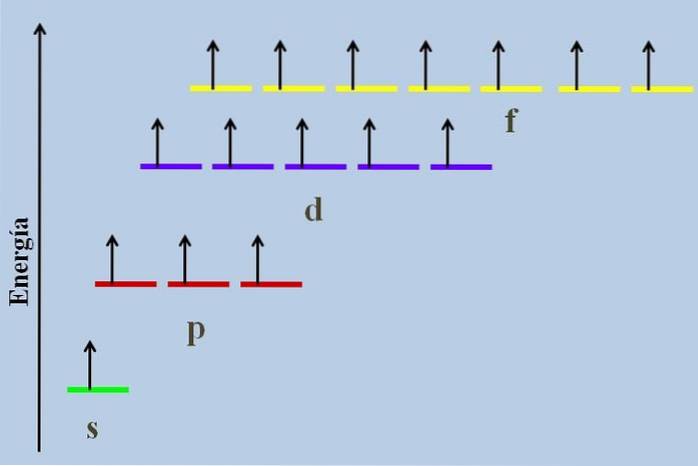
Entre eles existe uma diferença energética, embora pertençam ao mesmo nível n.
Por exemplo, a imagem acima mostra um esquema de energia com os orbitais ocupados por elétrons desemparelhados (um caso anormal). Pode-se observar que de todos os mais estáveis (o de menor energia) é o orbital ns (1s, 2s, ...), enquanto o nf é o mais instável (o de maior energia).
Índice do artigo
- 1 orbitais degenerados de um átomo isolado
- 1.1 Orbitais p
- 1.2 Orbitais d
- 1.3 Orbitais f
- 2 orbitais híbridos degenerados
- 3 referências
Orbitais degenerados de um átomo isolado
Orbitais degenerados, com o mesmo valor de n, eles estão na mesma linha em um esquema de energia. Por esta razão, as três listras vermelhas que simbolizam os orbitais p estão localizadas na mesma linha; assim como as listras roxas e amarelas da mesma maneira.
O diagrama da imagem viola a regra de Hund: os orbitais de energia mais alta são preenchidos com elétrons sem emparelhá-los primeiro com os de energia mais baixa. À medida que os elétrons se acasalam, o orbital perde energia e exerce uma repulsão eletrostática maior nos elétrons desemparelhados dos outros orbitais..
No entanto, esses efeitos não são considerados em muitos diagramas de energia. Se assim for, e obedecendo à regra de Hund sem preencher completamente os orbitais d, seria visto que eles deixam de ser degenerados.
Conforme mencionado anteriormente, cada orbital possui suas próprias características. Um átomo isolado, com sua configuração eletrônica, tem seus elétrons dispostos no número preciso de orbitais para acomodá-los. Apenas aqueles iguais em energia podem ser considerados degenerados.
Orbitais p
As três listras vermelhas para os orbitais p degenerados na imagem indicam que ambosx, pY E Pz eles possuem a mesma energia. Há um elétron desemparelhado em cada um, descrito por quatro números quânticos (n, eu, ml Y em), enquanto os três primeiros descrevem os orbitais.
A única diferença entre eles é denotada pelo momento magnético ml, que desenha o caminho de px em um eixo x, pY no eixo y, e pz no eixo z. Todos os três são iguais, mas diferem apenas em suas orientações espaciais. Por este motivo são sempre desenhados alinhados em energia, ou seja, degenerados.
Uma vez que são iguais, um átomo de nitrogênio isolado (com configuração 1sdois2sdois2 P3) deve manter seus três orbitais p degenerados. No entanto, o cenário de energia muda abruptamente se considerarmos um átomo N dentro de uma molécula ou composto químico..
Por quê? Porque embora px, pY E Pz são iguais em energia, isso pode variar em cada um deles se tiverem ambientes químicos diferentes; isto é, se eles se ligam a diferentes átomos.
Orbitais d
Existem cinco listras roxas que denotam os orbitais d. Em um átomo isolado, mesmo que tenham elétrons emparelhados, esses cinco orbitais são considerados degenerados. No entanto, ao contrário dos orbitais p, desta vez há uma diferença marcante em suas formas angulares.
Portanto, seus elétrons viajam em direções no espaço que variam de um orbital d para outro. Isso faz com que, de acordo com teoria do campo de cristal, que uma perturbação mínima causa um divisão de energia dos orbitais; ou seja, as cinco listras roxas se separam, deixando uma lacuna de energia entre elas:
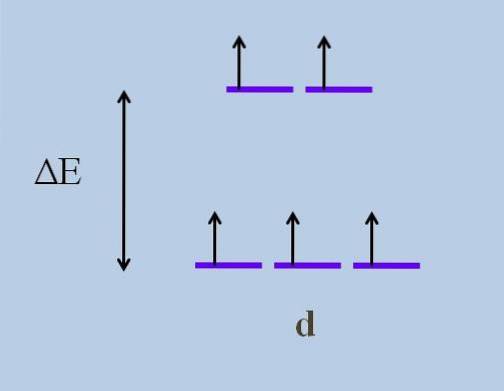
Quais são os orbitais superiores e quais são os orbitais inferiores? Aqueles acima são simbolizados como eg, e aqueles abaixo t2 g. Observe como inicialmente todas as listras roxas estavam alinhadas, e agora um conjunto de dois orbitais foi formado eg mais energético do que o outro conjunto de três orbitais t2 g.
Esta teoria permite explicar as transições d-d, às quais são atribuídas muitas das cores observadas nos compostos dos metais de transição (Cr, Mn, Fe, etc.). E qual é a causa desse distúrbio eletrônico? Para as interações de coordenação do centro de metal com outras moléculas chamadas ligantes.
Orbitais f
E com os orbitais f, as listras amarelas do feltro, a situação fica ainda mais complicada. Suas direções espaciais variam muito entre eles, e a exibição de seus links torna-se muito complexa.
Na verdade, os orbitais f são considerados tão revestidos internamente que não “participam de forma apreciável” na formação do vínculo..
Quando o átomo isolado com orbitais f envolve-se com outros átomos, as interações começam e ocorre o desdobramento (a perda da degeneração):
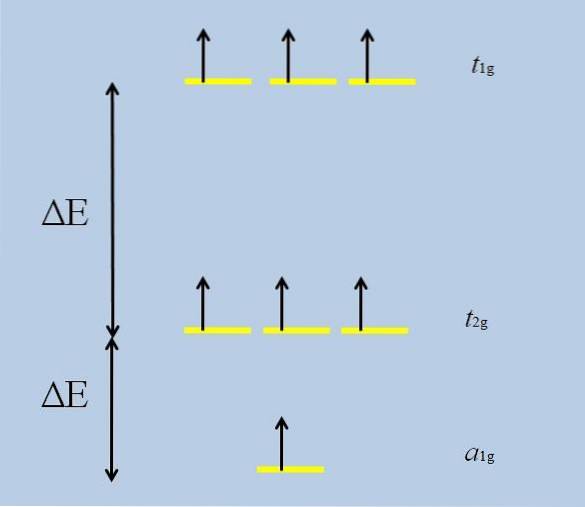
Observe que agora as listras amarelas formam três conjuntos: t1g, t2 g Y para1g, e que eles não são mais degenerados.
Orbitais Híbridos Degenerados
Foi visto que os orbitais podem se desdobrar e perder a degeneração. No entanto, embora isso explique as transições eletrônicas, empalidece na elucidação de como e por que existem diferentes geometrias moleculares. É aqui que entram os orbitais híbridos..
Quais são suas principais características? Que eles são degenerados. Assim, eles surgem da mistura de caracteres dos orbitais s, p, d e f, para originar híbridos degenerados.
Por exemplo, três orbitais p se misturam com um s para dar quatro orbitais sp3. Todos os orbitais sp3 são degenerados e, portanto, têm a mesma energia.
Se, adicionalmente, dois orbitais d são misturados com os quatro sp3, você terá seis orbitais sp3ddois.
E como eles explicam geometrias moleculares? Como existem seis, com energias iguais, eles devem ser orientados simetricamente no espaço para gerar ambientes químicos iguais (por exemplo, em um composto MF6).
Quando o fazem, um octaedro de coordenação é formado, que é igual a uma geometria octaédrica em torno de um centro (M).
No entanto, as geometrias costumam ser distorcidas, o que significa que mesmo os orbitais híbridos não são completamente degenerados. Portanto, a título de conclusão, orbitais degenerados só existem em átomos isolados ou em ambientes altamente simétricos..
Referências
- Dicionário Chemicool. (2017). Definição de Degenerado. Recuperado de: chemicool.com
- SparkNotes LLC. (2018). Átomos e orbitais atômicos. Recuperado de: sparknotes.com
- Química pura. (s.f.). Configuração eletronica. Recuperado de: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Moreno R. Esparza. (2009). Coordenação do curso de química: Campos e orbitais. [PDF]. Recuperado de: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.


Ainda sem comentários