
Estrutura, propriedades, usos, produção do acetato de potássio
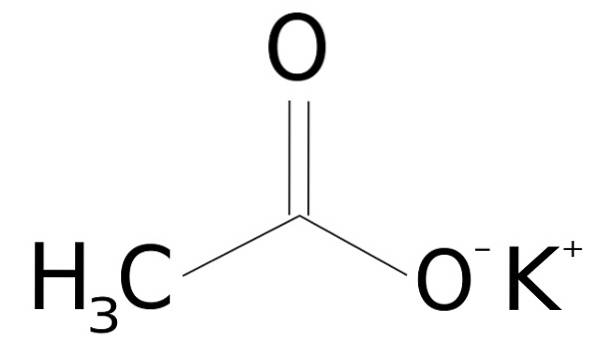
O acetato de potássio é um composto orgânico formado por um íon potássio K+ e um íon acetato CH3COO-. Sua fórmula química é CH3COOK ou KCH3COO, ou também CdoisH3KOdois. É um sólido cristalino incolor ou branco, muito solúvel em água..
É usado para regular a acidez de certos alimentos processados industrialmente. Devido à sua grande afinidade com a água, é utilizado em laboratórios ou em determinados processos para absorver água de outros compostos, como desidratar o álcool..

O acetato de potássio participa de algumas reações químicas como um acelerador destas e na síntese de compostos orgânicos. Também permite aumentar a formação de anticorpos (substâncias naturais que combatem infecções) em métodos industriais para produzi-los..
Suas propriedades de temperatura muito baixa o tornam um bom candidato para uso em misturas para derreter gelo em estradas de concreto em climas muito frios. Segundo fontes consultadas, também é utilizado em equipamentos de combate a incêndios e em montagens para observação de células em microscópios..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3,6 pH
- 3.7 Outras propriedades
- 3.8 Comportamento ao aquecer
- 4 Obtendo
- 5 usos
- 5.1 Em várias aplicações
- 5.2 Na indústria de polímeros
- 5.3 Em laboratórios de pesquisa científica e médica
- 5.4 Na produção industrial de anticorpos
- 5.5 Em misturas anticongelantes
- 5.6 Como funciona como anticongelante
- 6 referências
Estrutura
O acetato de potássio é feito de um cátion potássio K+ e um ânion acetato CH3COO-. Este último é a base conjugada de ácido acético CH3COOH. O íon acetato CH3COO- consiste em um metil -CH3 ligado a um carboxilato -COO-.
A união entre os dois íons é eletrostática ou iônica, ou seja, a união entre um íon positivo e um íon negativo.
Nomenclatura
- Acetato de potássio
- Etanoato de potássio
- Sal de potássio de ácido acético
- AcOK
- KOAc
Propriedades
Estado físico
Sólido cristalino incolor ou branco.
Peso molecular
98,14 g / mol
Ponto de fusão
292 ºC
Densidade
1,6 g / cm3
Solubilidade
Muito solúvel em água: 256 g / 100 mL a 20 ° C.
pH
Uma solução aquosa de acetato de potássio a 5% tem um pH de 7,5-9,0.
Outras propriedades
Às vezes, tem um leve cheiro de vinagre. Em solução a 10% não ataca o alumínio à temperatura ambiente, mas a 60-70 ° C o metal escurece e sofre corrosão.
Em concentrações de 20% ou mais, o ataque superficial ao alumínio ocorre em qualquer temperatura.
O acetato de potássio (AcOK) é altamente solúvel em água. Possui um hidrato: KCH3COO.1,5HdoisOu, qual é o sólido que é obtido por cristalização a partir de soluções aquosas de AcOK.
Comportamento quando aquecido
Se o acetato de potássio hidratado (AcOK) (KCH3COO.1,5HdoisO) quando chega a 40 ° C começa a perder a água de hidratação.
KCH3COO.1,5HdoisO → KCH3COO + 1,5HdoisOu ↑
Se o acetato de potássio anidro for aquecido (sem água: KCH3COO), ao atingir 340 ° C começa a se decompor formando carbonato de potássio KdoisCO3 de acordo com a seguinte reação:
2 KCH3COO + 4 Odois → KdoisCO3 + 3 HdoisO + 3 COdois↑
Obtendo
Pode ser preparado pela ação do hidróxido de potássio KOH em vários compostos, como o ácido acético CH3COOH, anidrido acético (CH3CO)doisO e acetato de amônio CH3COONH4.
KOH + CH3COOH → CH3COOK + HdoisOU
Também pode ser obtido pela reação de carbonato de potássio KdoisCO3 ou bicarbonato de potássio KHCO3 com ácido acético CH3COOH.
KHCO3 + CH3COOH → CH3COOK + HdoisO + COdois↑
O acetato de potássio pode ser cristalizado a partir de solução aquosa para obter alta pureza.
Formulários
Em várias aplicações
O acetato de potássio é usado na indústria de alimentos processados como um regulador de acidez. É usado como dessecante em métodos químicos para medir a permeabilidade ao vapor de água de alguns tecidos..
Atua como desidratante do etanol na produção desse álcool a partir da lignocelulose, um material derivado da madeira..
É usado para produzir antibióticos e é amplamente utilizado em equipamentos de combate a incêndio.
Na indústria de polímeros
É usado para reciclar poliuretanos, pois serve para catalisar ou acelerar as reações de hidrólise e glicólise dos referidos polímeros de modo que se tornem álcoois e aminas.
Também é utilizado na produção de resinas de silicone orgânicas.
Em laboratórios de pesquisa científica e médica
O acetato de potássio de alta pureza é usado em laboratórios como reagente em química analítica. Também para realizar pesquisas médico-científicas.
Em laboratórios de histopatologia, é usado para garantir um meio de pH neutro em configurações de microscópio..

É utilizado para a síntese de compostos orgânicos heterocíclicos, que são compostos com ciclos de tamanhos diferentes..
Certos microeletrodos usados para estudar as propriedades elétricas das células são preenchidos com uma solução concentrada de acetato de potássio..
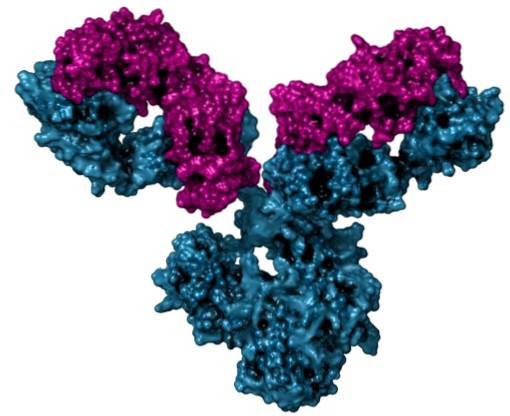
Na produção industrial de anticorpos
O acetato de potássio é usado para a produção em grande escala de anticorpos monoclonais (que são aqueles que vêm da mesma célula-tronco) em culturas de células. Permite estimular a síntese ou formação de anticorpos.
Os anticorpos são substâncias produzidas por algumas células do sangue para combater infecções causadas por vírus ou bactérias..

Em misturas anticongelantes
O acetato de potássio tem sido usado em misturas anticongelantes. anti-gelo), a fim de usá-los para derreter gelo em estradas e pavimentos de cimento e, assim, permitir o uso seguro destes.

A seleção do acetato de potássio (AcOK) para esta aplicação deve-se ao fato de que uma solução aquosa de AcOK a 50% em peso é eutética e tem um ponto de fusão de -62 ° C. Isso significa que mesmo em temperaturas tão baixas quanto -62 ° C, a solução permanece fundida..
Um eutético é uma mistura homogênea de componentes que possui o ponto de fusão mais baixo de todas as misturas possíveis destes, incluindo o dos componentes puros..
Como funciona como anticongelante
O acetato de potássio (AcOK) tem uma capacidade muito boa de derreter gelo.
A -5 ° C, é capaz de derreter 11,5 kg de gelo para cada kg de AcOK. Esta propriedade diminui à medida que a temperatura diminui, mas mesmo a -50 ° C tem a capacidade de derreter 1,3 Kg de gelo para cada Kg de AcOH..
A -5 ° C esta capacidade é comparável à do cloreto de sódio ou sal de cozinha (NaCl), enquanto a -30 ° C a excede em muito.

Porém, nos testes realizados com AcOK em conjunto com outros compostos, observou-se um certo grau de corrosão das superfícies cimentícias, pelo que se considerou a adição de agentes anticorrosivos às misturas anticongelantes..
Por outro lado, a mistura de acetato de potássio (CH3COOK) com formato de potássio (HCOOK) é um excelente anticongelante e não requer anticorrosivo.
Referências
- Baker, F.J. et al. (1976). Procedimentos de coloração. Mountants aquosos. Em Introdução à Tecnologia de Laboratório Médico (Quinta Edição). Recuperado de sciencedirect.com.
- Hassan, A.A. et al. (2018). Indazoles: Synthesis and Bond-Forming Heterocyclization. In Advances in Heterocyclic Chemistry. Recuperado de sciencedirect.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Acetato de potássio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Das, A. e Alagirusamy, R. (2010). Transmissão de umidade. Método de copo invertido com dessecante. In Science in Clothing Comfort. Recuperado de sciencedirect.com.
- Vargel, C. (2004). Ácidos carboxílicos e seus derivados. Acetatos. Em corrosão do alumínio. Recuperado de sciencedirect.com.
- Cuevas, J. (2014). Técnicas de registro eletrofisiológico. Técnicas de gravação intracelular. No Módulo de Referência em Ciências Biomédicas. Recuperado de sciencedirect.com.
- Fink, J.K. (2018). Poli (uretano) s. Reciclando. Solvólise. In Reactive Polymers: Fundamentals and Applications (Terceira edição). Recuperado de sciencedirect.com.
- Fong, W. et al. (1997). Otimização da produção de anticorpos monoclonais: efeitos combinados de acetato de potássio e perfusão em um biorreator de tanque agitado. Cytotechnology 24: 47-54. Recuperado de link.springer.com.
- Danilov, V.P. et al. (2012). Reagentes anticongelantes de baixa temperatura em sistemas de sais aquosos contendo acetatos e formulações. Theoretical Foundations of Chemical Engineering, 2012, Vol 46, No. 5, pp. 528-535. Recuperado de link.springer.com.
- Fakeev, A.A. et al. (2012). Pesquisa e Desenvolvimento de Método para Acetato de Potássio de Alta Pureza. Journal of Applied Chemistry, 2012, Vol. 85, No. 12, pp. 1807-1813. Recuperado de link.springer.com.


Ainda sem comentários