
Fórmula de óxido de chumbo (PbO), propriedades, riscos e usos

O ferrugem de prumo, Óxido de chumbo (II) ou monóxido de chumbo, é um composto químico com a fórmula PbO. É encontrado em dois polimorfos: litharge e masicotita. Sua estrutura é ilustrada na figura 1.
Voltando à composição, litharge é o produto oxidado de chumbo derretido que foi agitado ou atomizado para incorporar ar, depois resfriado e moído para formar o pó amarelo..
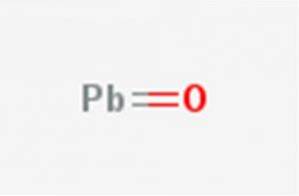
O nome masicotita é usado tanto para o mineral nativo quanto para o produto monóxido de chumbo produzido pelo aquecimento do carbonato de chumbo a 300ºC (Monóxido de chumbo, 2016). Esses minerais são mostrados na figura 2.

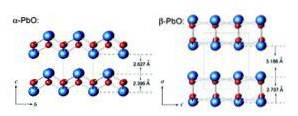
A masicotita tem uma estrutura ortorrômbica enquanto a litharge tem uma estrutura cristalina tetragonal. O óxido de chumbo (II) tem a capacidade de mudar a estrutura quando aquecido ou resfriado. Essas estruturas são mostradas na figura 3.
O PbO é produzido pela oxidação do chumbo metálico. O metal é derretido para fazer comprimidos de chumbo e, em seguida, eles são triturados entre 170 ~ 210 ° C e passados pela chama para oxidação em temperaturas acima de 600 ℃. Os produtos de óxido são esmagados para obter o óxido de chumbo acabado (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
O PbO é produzido em larga escala como intermediário no refino de minérios de chumbo em chumbo metálico. O mineral de chumbo usado é galena (sulfeto de chumbo (II)). Em alta temperatura (1000 ° C), o sulfeto é convertido em óxido da seguinte forma:
2PbS + 3O2 → 2PbO + 2SO2
Índice do artigo
- 1 Propriedades físicas e químicas da ferrugem do prumo
- 2 Reatividade e perigos
- 3 usos
- 4 referências
Propriedades físicas e químicas do óxido de prumo
O monóxido de chumbo pode apresentar duas aparências diferentes: como um pó seco amarelo com uma estrutura ortorrômbica (masicotita) ou como um cristal tetragonal avermelhado (litharge). Ambas as formas são ilustradas na figura 4.

O composto tem um peso molecular de 223,20 g / mol e uma densidade de 9,53 g / ml. Tem um ponto de fusão de 888 ° C e um ponto de ebulição de 1470 ° C (National Center for Biotechnology Information, S.F.).
O composto é muito pouco solúvel em água, sendo capaz de dissolver apenas 0,0504 gramas por litro a 25 ° C na forma de masicotita e 0,1065 gramas por litro a 25 ° C na forma de litharge. O composto também é insolúvel em álcool. É solúvel em ácido acético, HNO3 diluído e álcalis (Royal Society of Chemistry, 2015).
O composto é um agente oxidante ou redutor fraco, entretanto, reações redox ainda podem ocorrer. Esses compostos não são reativos à água.
O óxido de chumbo oxida o carboneto de alumínio com incandescência quando aquecido. Misturas de óxido de chumbo com pó de alumínio (como com outros metais: sódio, zircônio) dão uma explosão violenta.
Reatividade e perigos
O monóxido de chumbo é um composto classificado como venenoso. A substância é tóxica para o sistema nervoso central e pode ser cancerígena em humanos (Folha de Dados de Segurança do Material, óxido de chumbo, amarelo, 2013).
O sintoma inicial de envenenamento são linhas de chumbo que aparecem nas bordas das gengivas e a pele fica cinza. A síndrome neurastênica também surgirá no período inicial do envenenamento..
O envenenamento cerebelar pode resultar em depressão por envenenamento por chumbo, mania de envenenamento por chumbo, bem como toxicidade por chumbo e sensibilidade à paralisia por neurite múltipla.
O envenenamento por chumbo também pode causar anemia hipocrômica e distúrbios endócrinos e metabólicos. Além disso, o envenenamento por chumbo pode inibir a atividade de certas enzimas no sistema digestivo e causar indigestão, dor abdominal intensa e danos ao fígado. Também pode causar hipertensão e aumento do colesterol..
Se houver dor abdominal intensa, algumas medidas podem ser tomadas, como injeção subcutânea de atropina e outras drogas, abdome quente, enema, banho quente e assim por diante. A concentração máxima permitida no ar é de 0,01 mg / m3 (Monóxido de chumbo, 2016).
Em caso de contato com os olhos ou com a pele, lavar com água em abundância. Em caso de inalação ou ingestão, a vítima deve ser conduzida para local ventilado. O vômito não deve ser induzido. Se a vítima não estiver respirando, a ressuscitação boca-a-boca deve ser administrada.
Em todos os casos, deve-se procurar atendimento médico imediato. O monóxido de chumbo é um composto prejudicial ao meio ambiente, a bioacumulação deste produto químico pode ocorrer em plantas e mamíferos..
É altamente recomendável que esta substância não entre no meio ambiente, por isso deve ser manuseada e armazenada de acordo com as estipulações estabelecidas (Instituto Nacional de Segurança e Saúde Ocupacional, 2015).
Formulários
O monóxido de chumbo tem sido usado como um secador de tinta e como um baixo fluxo de fogo na fabricação de cerâmica e vidro. O vidro de cristal de chumbo é usado na fabricação de louças de mesa de alta qualidade.
Utilizando o monóxido de chumbo como fundente, é possível obter um vidro com alto índice de refração e, consequentemente, o brilho desejado (British Encyclopedia, 2016)..
Os condutores cerâmicos semimetálicos têm as condutividades mais altas de todas as cerâmicas, exceto as supercondutoras. O óxido de chumbo é um exemplo desse tipo de cerâmica semimetálica. Esses materiais têm bandas de energia de elétrons sobrepostas e, portanto, são excelentes condutores eletrônicos (Mason, 2008).
O óxido de chumbo é usado principalmente em tubos de elétrons, tubos de imagem, vidro óptico, vidro de chumbo anti-raio X e borrachas resistentes à radiação..
É utilizado como reagente analítico, o fluxo de silicato, mas também para precipitação de aminoácidos.
O óxido de chumbo é usado na fabricação de estabilizante de plástico de PVC e também é a matéria-prima para outros sais de chumbo. Também é usado no refino de petróleo e na determinação de ouro e prata..
Também é usado como pigmento amarelo em tintas e esmaltes. A masicotita foi usada como pigmento por artistas dos séculos 15 a 18.
Camadas finas de monóxido de chumbo são usadas para produzir cores iridescentes em latão e bronze. Litharge é misturado com glicerol para fazer cimento de encanador.
Referências
- Encyclopedia Britannica. (2016, 10 de outubro). Vidro. Recuperado da britannica: britannica.com.
- Kirk-Othmer. (novecentos e noventa e cinco). Enciclopédia de Tecnologia Química. 4ª ed. Volumes 1. Nova York: John Wiley and Sons.
- Monóxido de chumbo. (2016, 1º de maio). Recuperado de cameo.mfa: cameo.mfa.org.
- Monóxido de chumbo. (2016). Recuperado de chemicalbook: chemicalbook.com.
- Mason, T. O. (12 de março de 2008). Cerâmica condutiva. Recuperado da britannica: britannica.com.
- Folha de Dados de Segurança do Material: Óxido de chumbo, amarelo. (2013, 21 de maio). Recuperado do sciencelab: sciencelab.com.
- Centro Nacional de Informações sobre Biotecnologia. (S.F.). PubChem Compound Database; CID = 14827. Recuperado do PubChem: pubchem.ncbi.nlm.nih.gov.
- Instituto Nacional de Segurança e Saúde Ocupacional. (2015, 22 de julho). LEAD (II) OXIDE. Recuperado de cdc.gov: cdc.gov.
- Royal Society of Chemistry. (2015). Óxido de chumbo (II). Recuperado de chemspider: chemspider.com.

Ainda sem comentários