
Estrutura, fórmula, propriedades, riscos do óxido de sódio (Na2O)

O óxido de sódio é um composto inorgânico de fórmula NadoisO. Como todos os óxidos de metal alcalino, tem uma estrutura cristalina semelhante à antifluorita (semelhante à fluorita, CaF2, mas com cátions e ânions invertidos) correspondendo ao cúbico de face centrada. (Sódio: óxido dissódico, 1993-2016).
Pode-se dizer que o óxido de sódio é o anidrido do hidróxido de sódio, uma vez que reage com a água para formar dois moles deste composto da seguinte forma:
N / DdoisO + HdoisO → 2 NaOH
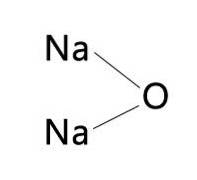
Geralmente, o nome KNaO pode ser encontrado escrito, referindo-se a óxido de sódio ou óxido de potássio. Isso ocorre porque os dois óxidos têm propriedades semelhantes em termos de cor e taxas de expansão e contração..
Fontes insolúveis de óxido de sódio frequentemente incluem traços de óxido de potássio, por exemplo em feldspatos (figura 2), que são a principal fonte de sódio em certos esmaltes (Britt, 2007).

Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 3 usos
- 4 referências
Propriedades físicas e químicas
O óxido de sódio é um sólido cristalino branco (Figura 3). Tem um peso molecular de 61,98 g / mol, tem uma densidade de 2,27 g / ml e um ponto de fusão de 1275 ° C..
O composto tem um ponto de ebulição de 1950 ° C, onde começa a se decompor em peróxido de sódio e sódio metálico, no entanto, uma propriedade interessante é que o óxido de sódio começa a sublimar a 1100 ° C (National Center for Biotechnology Information, SF).

Reage violentamente com água e álcool para formar hidróxido de sódio. Óxido de sódio, NadoisOu, ele absorve de forma reversível hidrogênio (Hdois), para formar hidreto de sódio (NaH) e hidróxido de sódio (NaOH), que tem o potencial de encontrar sua aplicação no armazenamento reversível de hidrogênio.
Reatividade e perigos
O óxido de sódio é um composto estável não inflamável, mas pode reagir violentamente com ácidos e água. Também pode aumentar a combustão de outras substâncias. É classificado como corrosivo e pode queimar a pele e os olhos (Royal Society of Chemistry, 2015).
A solução em água é uma base forte, pois reage violentamente com ácidos corrosivos. Reagir violentamente com a água produz hidróxido de sódio, atacando muitos metais na presença de água.
A substância também é corrosiva para o trato respiratório e quando ingerida. A inalação de aerossol pode causar edema pulmonar (Instituto Nacional de Segurança e Saúde Ocupacional, 2014).
Em caso de inalação, a pessoa afetada deve ser removida para um local fresco. Se a vítima não estiver respirando, deve-se administrar respiração artificial. Mais tarde, vá ou consulte um médico o mais rápido possível.
Em caso de contato com a pele, roupas e sapatos contaminados devem ser retirados imediatamente e lavados com água em abundância..
Em caso de contato com os olhos, enxágue com água em abundância por no mínimo 15 minutos e consulte um médico. Se ingerido, não induza ao vômito, mas enxágue a boca com água e consulte um médico..
Os sintomas e efeitos mais importantes podem ser: espasmos, inflamação e edema da laringe e brônquios, pneumonite, edema pulmonar, sensação de queimação, tosse, respiração ofegante, laringite e dificuldade em respirar (óxido de sódio (Na2O) (cas 1313-59-3 ) MSDS, 2010-2017).
Os sintomas de edema pulmonar frequentemente não aparecem por algumas horas e são agravados por esforços físicos. O repouso e a observação médica são, portanto, essenciais.
O óxido de sódio deve ser armazenado em local seco e separado dos ácidos fortes. Como o composto reage violentamente com a água, em caso de incêndio, extintores ou sprinklers de base aquosa não devem ser usados. Recomenda-se o uso de pó seco ou areia.
Formulários
O principal uso do óxido de sódio é na fabricação de vidro. É utilizado em cerâmicas e vidros, embora não na forma bruta. O óxido de sódio geralmente constitui cerca de 15% da composição química do vidro.
Reduz a temperatura de fusão do dióxido de silício (70% da composição do vidro), tornando a produção do vidro mais barata e mais eficiente, pois requer menor gasto de energia por parte do fabricante (George Sumner, sd).
O vidro sódio-cal é a forma mais comum de vidro produzido, compreendendo aproximadamente 70% de sílica (dióxido de silício), 15% de soda (óxido de sódio) e 9% de cal (óxido de cálcio), com quantidades muito maiores. Pequeno de outros compostos.
O óxido de sódio serve como um fundente para baixar a temperatura na qual a sílica derrete, e a cal atua como um estabilizador para a sílica. O vidro sódio-cal é barato, quimicamente estável, razoavelmente duro e extremamente trabalhável, porque pode ser amolecido várias vezes, se necessário..
Essas qualidades o tornam adequado para a fabricação de uma ampla gama de produtos de vidro, incluindo lâmpadas, vidros, garrafas e objetos de arte..
Por outro lado, o óxido de sódio e a sílica contêm cristal de água, também chamado de silicato de sódio ou vidro de água, que forma um sólido vítreo com a propriedade muito útil de ser solúvel em água..
O copo de água é vendido como pedaços ou pós sólidos, ou como um líquido transparente e xaroposo. É usado como uma fonte conveniente de sódio para muitos produtos industriais, como: um construtor em detergentes para a roupa, como um aglutinante e adesivo, como um floculante em estações de tratamento de água e em muitas outras aplicações (Enciclopaedia britannica, 2017).
Os compostos de óxido não conduzem eletricidade. No entanto, certos óxidos estruturados de perovskita são condutores eletrônicos para aplicação no cátodo de células a combustível de óxido sólido e sistemas de geração de oxigênio (American Elements, 1998-2017)..
Referências
- Instituto Nacional de Segurança e Saúde Ocupacional. (2014, 1º de julho). ÓXIDO DE SÓDIO CDC. Recuperado do cdc.
- Elementos americanos. (1998-2017). Óxido de sódio. Recuperado de americanelements.com.
- Britt, J. (2007). O guia completo para esmaltes de alto fogo. Nova York: Lark Books.
- Enciclopédia Britannica. (2017). Composto químico de óxido de sódio. Recuperado da britannica.com.
- George Sumner, D. J. (s.f.). Quais são alguns dos usos do óxido de sódio? Recuperado de quora.com.
- Centro Nacional de Informações sobre Biotecnologia. (S.F.). PubChem Compound Database; CID = 73971. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Óxido de sódio. Recuperado de chemspider.com.
- Ruitao Wang, T. K. (2006). Reação do hidrogênio com o óxido de sódio: Um sistema reversível de hidrogenação / desidrogenação. Journal of Power Sources, Volume 155, Issue 2, 167-171. sciencedirect.com.
- Óxido de sódio (Na2O) (cas 1313-59-3) MSDS. (2010-2017). Recuperado de guidechem: guidechem.com.
- Sódio: óxido dissódico. (1993-2016). Recuperado de webelements: webelements.com.


Ainda sem comentários