
Estrutura do óxido de cromo (III), nomenclatura, propriedades, usos
O óxido de cromo (III) O óxido crômico é um sólido inorgânico verde que é formado pela queima de cromo metálico (Cr) em oxigênio (Odois), deixando o cromo com um estado de oxidação 3+. Sua fórmula química é CrdoisOU3. Na natureza, é encontrado no mineral Eskolaíta. Nenhum depósito natural utilizável de óxido de cromo (III) é conhecido.
Pode ser preparado, entre outras formas, pelo aquecimento de CrdoisOU3 hidratado (CrdoisOU3.nHdoisO) para remover completamente a água. Também é obtido como produto da calcinação do óxido de cromo (VI) (CrO3).

Porém, a melhor forma de obtê-lo puro é pela decomposição do dicromato de amônio (NH4)doisCrdoisOU7 a 200 ° C. Industrialmente é produzido por redução de dicromato de sódio (NadoisCrdoisOU7) sólido com enxofre.
Quando está finamente dividido, apresenta uma cor verde brilhante com matizes amarelados. Mas se as partículas forem maiores, ele exibe uma tonalidade azulada. O óxido crômico é o pigmento verde mais estável conhecido. Sua resistência térmica e química o torna um corante cerâmico valioso.
É utilizado em tintas industriais, vernizes, na construção civil, em joalheria, como corante em cosméticos ou em produtos farmacêuticos, entre outras aplicações..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Dureza de Mohs
- 3.3 Peso molecular
- 3.4 Ponto de fusão
- 3,5 Densidade
- 3.6 Solubilidade
- 3,7 pH
- 3.8 Índice de refração
- 3.9 Outras propriedades
- 4 usos
- 4.1 Na indústria de cerâmica e vidro
- 4.2 Em revestimentos industriais
- 4.3 Na indústria de refratários
- 4.4 Em construção
- 4.5 Como pigmento em várias aplicações
- 4.6 Em joias
- 4.7 Na catálise de reações químicas
- 4.8 Na fabricação de cromo
- 4.9 Em materiais magnéticos
- 4.10 Inovações recentes
- 5 referências
Estrutura
Óxido Α-CrdoisOU3 Possui a estrutura do tipo corindo. Seu sistema cristalino é romboédrico hexagonal. É isomórfico com α-alumina e α-FedoisOU3.
A eskolaíta, um mineral natural de óxido de cromo (III), tem a estrutura mostrada a seguir:
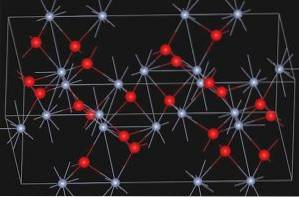
Nomenclatura
- Óxido de cromo (III).
- Óxido de cromo verde.
- Trióxido dicrômico.
- Sesquióxido de cromo.
- Cromo.
- Eskolaíta: Mineral de óxido de cromo (III).
- Hidratar: CrdoisOU3.nHdoisO (onde n ≅ 2) é chamado de Hidrato de Óxido de Cromo (III) ou Verde Guignet.

Propriedades
Estado físico
Sólido cristalino.
Dureza de Mohs
9 (seus cristais são extremamente duros).
Peso molecular
151,99 g / mol.
Ponto de fusão
Ele derrete a 2.435 ° C, mas começa a evaporar a 2.000 ° C, formando nuvens de fumaça verde..
Densidade
5,22 g / cm3
Solubilidade
Quando aquecido a altas temperaturas, é praticamente insolúvel em água (3 microgramas / L a 20ºC); insolúvel em álcoois e acetona; ligeiramente solúvel em ácidos e álcalis; sSolúvel em ácido perclórico (HClO4) a 70%, em que se decompõe.
pH
6.
Índice de refração
2.551.
Outras propriedades
- Se for fortemente calcinado, torna-se inerte em relação aos ácidos e às bases. Caso contrário, o CrdoisOU3 e sua forma hidratada CrdoisOU3.nHdoisOu são anfotéricos, dissolvendo-se facilmente em ácido para dar íons água [Cr (HdoisOU)6]3+, e em álcali concentrado para formar "cromita".
- Quando calcinado, é quimicamente resistente a ácidos, álcalis e altas temperaturas. É extremamente estável para SOdois.
- Possui excelente resistência à luz devido ao fato de seus cristais possuírem opacidade, alta atenuação UV e transparência à luz visível..
- É um material extremamente duro, pode riscar quartzo, topázio e zircônio.
- Seu hidrato CrdoisOU3.nHdoisO (onde n ≅ 2) não possui estabilidade térmica, sua água de hidratação limita sua aplicabilidade a menos de 260 ºC. Baixa capacidade de tingimento e gama limitada de tonalidades.
- Mas esse hidrato tem uma tonalidade azul esverdeada muito limpa e brilhante. É semitransparente, apresenta baixa opacidade, excelente resistência à luz e aos álcalis.
- O crdoisOU3 Não é classificado como material perigoso e é considerado um pó fino inerte. Não está sujeito aos regulamentos de transporte internacionais.
- Não irrita a pele ou as membranas mucosas.
Formulários
Na indústria de cerâmica e vidro
Devido à sua alta resistência ao calor e resistência química, CrdoisOU3 calcinado é utilizado como corante ou pigmento vitrificável na fabricação de cerâmicas, em esmaltes de porcelana e misturas de vidro.
Em revestimentos industriais
A cerâmica de óxido de cromo (III) oferece excelente resistência contra a maioria dos ambientes corrosivos. Tudo isso através do mecanismo de exclusão do substrato do ambiente que o circunda..
Por esse motivo, é utilizado em revestimentos para evitar a corrosão de diversos materiais, sendo aplicado por pulverização térmica (atomização ou spray quente)..
Também é usado como proteção contra o desgaste abrasivo (quando a remoção do material é causada por partículas que se movem através de uma superfície).
Nestes casos, a aplicação de um revestimento de CrdoisOU3 por deposição de plasma, gera alta resistência à abrasão.
Os dois casos anteriores são úteis, por exemplo, em motores de turbina a gás na indústria aeroespacial..
Na indústria de refratários
Utilizado na produção de tijolos termicamente e quimicamente resistentes, materiais de revestimento e concreto refratário à base de alumina..
Em construção
Por ser extremamente resistente às condições atmosféricas, luz e calor, é aplicado como corante de rocha granulada em telhados asfálticos, cimento de concreto, revestimentos industriais de alta qualidade para exteriores, construções de aço e revestimentos de fachadas (tintas emulsionáveis)..
Como pigmento em várias aplicações
Pode suportar condições de vulcanização e não se degrada, por isso é usado na pigmentação de borracha.
Por ser atóxico, é utilizado como pigmento para brinquedos, cosméticos (principalmente seu hidrato), plásticos, tintas de impressão, tintas que entram em contato com alimentos e produtos farmacêuticos.
Na indústria de pigmentos, é utilizado como matéria-prima para a produção de tintas penetrantes contendo cromo e em pigmentos à base de fases de óxido metálico misto. Também é usado como um corante de tinta para revestimento de bobinas.
Seu hidratado tem uma transparência que permite a formulação de acabamentos policromáticos na indústria automotiva (acabamentos metálicos de automóveis).
Devido à sua característica única de refletir a radiação infravermelha (IR) de forma semelhante à clorofila nas plantas, sob luz infravermelha parece folhagem. Por esse motivo, é amplamente utilizado em tintas de camuflagem ou revestimentos para aplicações militares..
Em joias
É usado como corante para gemas sintéticas. Quando Cr é introduzidodoisOU3 como uma impureza na rede cristalina de α-AldoisOU3, como no rubi mineral semiprecioso, a cor é vermelha em vez de verde.
Também é usado como agente de lixamento e polimento por sua alta dureza e propriedades abrasivas..
Na catálise de reações químicas
Suportado em alumina (AldoisOU3) ou outros óxidos, é utilizado em química orgânica como catalisador, por exemplo, na hidrogenação de ésteres ou aldeídos para formar álcoois e na ciclização de hidrocarbonetos. Catalisa a reação de nitrogênio (Ndois) com hidrogênio (Hdois) para formar amônia (NH3).
Devido à sua capacidade de oxidação-redução, atuando em conjunto com o óxido de cromo (VI), desempenha um papel importante na desidrogenação de alcanos com CO.dois para produzir propeno e isobuteno, uma vez que o ciclo de desativação-reativação do catalisador é facilmente executável. Ele também é usado como um catalisador em química inorgânica.
Na fabricação de cromo
É utilizado na produção aluminotérmica de cromo metálico puro. Para isso, deve ser aquecido a 1000 ºC para aumentar seu tamanho de grão..

Em materiais magnéticos
Foi adicionado em pequenas quantidades a materiais magnéticos em fitas de áudio e vídeo, conferindo um efeito de autolimpeza às cabeças de som..
Inovações recentes
Pigmentos tendo melhorado perto de refletância de IR foram obtidos por dopagem de nanopartículas de CrdoisOU3 com sais de elementos pertencentes ao grupo das terras raras, como lantânio e praseodímio.
Ao aumentar a concentração desses elementos, a refletância solar no infravermelho próximo aumenta sem afetar a cor verde do pigmento Cr.doisOU3.
Isso permite que CrdoisOU3 dopado como um pigmento "frio", pois é adequado para controlar o aumento de calor.
Aplicado em tetos, automóveis e estofados, entre outras aplicações, atinge uma alta refletância da luz solar IR, o que permite reduzir consideravelmente o aumento de calor nos ambientes.
Referências
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopédia de Tecnologia Química. Volume 19. Quarta edição. John Wiley & Sons.
- Enciclopédia de Química Industrial de Ullmann. (1990). Quinta edição. Volume A7 e A20. VCH Verlagsgesellschaft mbH.
- Elementos americanos. (2019). Óxido de cromo (III). Recuperado de americanelements.com.
- Biblioteca Nacional de Medicina. (2019). Óxido de cromo (III). Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Dorfman, Mitchell R. (2012). Revestimentos de spray térmico. No Manual de Degradação Ambiental de Materiais. Capítulo 19. Recuperado de sciencedirect.com.
- Takehira, K. et al. (2004). COdois Desidrogenação de propano sobre o catalisador Cr-MCM-41. Em Studies in Surface Science and Catalysis 153. Recuperado de sciencedirect.com.
- Selvam Sangeetha et al. (2012). Pigmentos funcionais de nanopartículas de óxido de cromo (III). Dyes and Pigments 94 (2012) 548-552. Recuperado de sciencedirect.com.

Ainda sem comentários