
Conceito e fórmula de volume molar, cálculo e exemplos
O volume molar É uma propriedade intensiva que indica quanto espaço uma toupeira de uma determinada substância ou composto ocupa. É representado pelo símbolo Vm, y é expresso em unidades de dm3/ mol para gases e cm3/ mol para líquidos e sólidos, porque os últimos são mais confinados por suas forças intermoleculares mais altas.
Esta propriedade é recorrente no estudo de sistemas termodinâmicos que envolvem gases; uma vez que, para líquidos e sólidos, as equações para determinar Vm eles se tornam mais complicados e imprecisos. Portanto, no que diz respeito aos cursos básicos, o volume molar está sempre associado à teoria do gás ideal..
Isso se deve ao fato de que aspectos estruturais são irrelevantes para gases ideais ou perfeitos; todas as suas partículas são visualizadas como esferas que colidem elasticamente umas com as outras e se comportam da mesma forma, não importa quais sejam suas massas ou propriedades.
Sendo assim, um mol de qualquer gás ideal ocupará, a uma dada pressão e temperatura, o mesmo volume Vm. Diz-se então que em condições normais de P e T, 1 atm e 0 ºC, respectivamente, um mol de um gás ideal ocupará um volume de 22,4 litros. Este valor é útil e aproximado, mesmo ao avaliar gases reais.
Índice do artigo
- 1 Conceito e fórmula
- 1.1 Para gases
- 1.2 Para líquidos e sólidos
- 2 Como calcular o volume molar?
- 3 Exemplos de cálculo do volume molar
- 3.1 Exemplo 1
- 3.2 Exercício 2
- 3.3 Exercício 3
- 4 referências
Conceito e fórmula
Para gases
A fórmula imediata para calcular o volume molar de uma espécie é:
Vm = V / n
Onde V é o volume que ocupa, e n a quantidade da espécie em moles. O problema é que Vm depende da pressão e temperatura que as moléculas experimentam, e uma expressão matemática que leve essas variáveis em consideração é desejada.
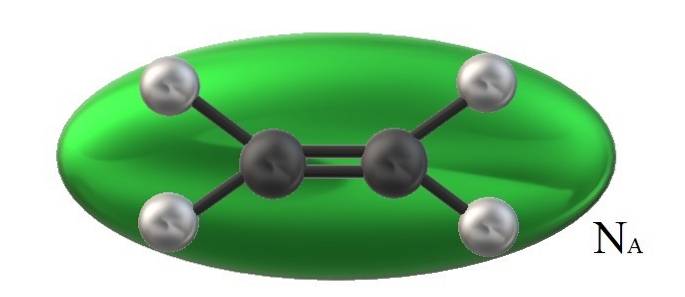
O etileno na imagem, HdoisC = CHdois, tem um volume molecular associado limitado por um elipsóide verde. Este HdoisC = CHdois Ele pode girar de várias maneiras, como se o referido elipsóide fosse movido no espaço para visualizar quanto volume ocuparia (obviamente insignificante).
No entanto, se o volume de tal elipsóide verde, nós o multiplicamos por NPARA, Com o número de Avogadro, teremos então um mol de moléculas de etileno; uma toupeira de elipsóides interagindo uns com os outros. Em temperaturas mais altas, as moléculas se separarão umas das outras; enquanto sob pressão mais alta, eles irão se contrair e reduzir seu volume.
Portanto, Vm é dependente de P e T. O etileno tem uma geometria plana, então não se pode pensar que seu Vm é precisa e exatamente igual ao do metano, CH4, de geometria tetraédrica e capaz de ser representada por uma esfera e não um elipsóide.
Para líquidos e sólidos
As moléculas ou átomos de líquidos e sólidos também têm seus próprios Vm, que pode ser aproximadamente relacionado à sua densidade:
Vm = m / (dn)
A temperatura afeta o volume molar para líquidos e sólidos mais do que a pressão, desde que esta não varie muito ou seja exorbitante (na ordem de GPa). Da mesma forma, como mencionado com o etileno, as geometrias e estruturas moleculares têm grande influência nos valores de Vm.
Porém, em condições normais, observa-se que as densidades para diferentes líquidos ou sólidos não variam muito em suas magnitudes; o mesmo vale para seus volumes molares. Observe que quanto mais densos eles forem, menor será Vm.
Em relação aos sólidos, seu volume molar também depende de suas estruturas cristalinas (o volume de sua célula unitária)..
Como calcular o volume molar?
Ao contrário de líquidos e sólidos, para gases ideais existe uma equação que nos permite calcular Vm em função de P e T e suas mudanças; isto é, o de gases ideais:
P = nRT / V
Que acomoda expressar V / n:
V / n = RT / P
Vm = RT / P
Se usarmos a constante de gás R = 0,082 L atm K-1Verruga-1, então as temperaturas devem ser expressas em kelvin (K) e as pressões em atmosferas. Observe que aqui podemos ver porque Vm é uma propriedade intensiva: T e P não têm nada a ver com a massa do gás, mas com seu volume.
Esses cálculos são válidos apenas em condições em que os gases se comportam perto da idealidade. Porém, os valores obtidos por meio da experimentação possuem uma pequena margem de erro em relação ao teórico..
Exemplos de cálculo do volume molar
Exemplo 1
Existe um gás Y cuja densidade é 8,5 · 10-4 g / cm3. Se tivermos 16 gramas equivalentes a 0,92 moles de Y, calcule seu volume molar.
A partir da fórmula de densidade, podemos calcular qual volume de Y esses 16 gramas ocupam:
V = 16 g / (8,5 10-4 g / cm3)
= 18,823,52 cm3 ou 18,82 L
Então Vm É calculado diretamente dividindo este volume pelo número de moles dado:
Vm = 18,82 L / 0,92 mol
= 20,45 L / mol ou L mol-1 ou dm3Verruga-1
Exercício 2
No exemplo anterior de Y, não foi especificado em nenhum momento qual era a temperatura que as partículas do referido gás estavam experimentando. Supondo que Y foi trabalhado à pressão atmosférica, calcule a temperatura necessária para comprimi-lo até o volume molar determinado.
A declaração do exercício é mais longa do que sua resolução. Usamos a equação:
Vm = RT / P
Mas resolvemos para T, e sabendo que a pressão atmosférica é de 1 atm, resolvemos:
T = VmP / R
= (20,45 L / mol) (1 atm) / (0,082 L atm / K mol)
= 249,39 K
Ou seja, um mol de Y ocupará 20,45 litros a uma temperatura próxima a -23,76 ºC.
Exercício 3
Seguindo os resultados anteriores, determine Vm a 0 ºC, 25 ºC e a zero absoluto na pressão atmosférica.
Transformando as temperaturas em Kelvin, primeiro temos 273,17 K, 298,15 K e 0 K. Resolvemos diretamente substituindo a primeira e a segunda temperaturas:
Vm = RT / P
= (0,082 L atm / K mol) (273,15 K) / 1 atm
= 22,40 L / mol (0 ºC)
= (0,082 L atm / K mol) (298,15 K) / 1 atm
= 24,45 L / mol (25ºC)
O valor de 22,4 litros foi mencionado no início. Observe como Vm aumenta com a temperatura. Quando queremos fazer o mesmo cálculo com zero absoluto, tropeçamos na terceira lei da termodinâmica:
(0,082 L atm / K mol) (0 K) / 1 atm
= 0 L / mol (-273,15 ºC)
O gás Y não pode ter um volume molar inexistente; isso significa que ele foi transformado em um líquido e a equação anterior não é mais válida.
Por outro lado, a impossibilidade de calcular Vm no zero absoluto obedece à terceira lei da termodinâmica, que diz que é impossível resfriar qualquer substância à temperatura do zero absoluto.
Referências
- Ira N. Levine. (2014). Princípios de Físicoquímica. Sexta edição. Mc Graw Hill.
- Glasstone. (1970). Tratado de físico-química. Segunda edição. Aguilar.
- Wikipedia. (2019). Volume molar. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (8 de agosto de 2019). Definição de volume molar em química. Recuperado de: Thoughtco.com
- BYJU'S. (2019). Fórmula do volume molar. Recuperado de: byjus.com
- González Monica. (28 de outubro de 2010). Volume molar. Recuperado de: quimica.laguia2000.com



Ainda sem comentários