
Estrutura, propriedades e usos do sulfeto de zinco (ZnS)
O sulfeto de zinco é um composto inorgânico de fórmula ZnS, formado por cátions Zndois+ e S ânionsdois-. É encontrada na natureza principalmente como dois minerais: wurtzita e esfalerita (ou zinco blenda), sendo esta última sua forma principal..
Esfalerita é negra por natureza devido às impurezas que apresenta. Em sua forma pura, possui cristais brancos, enquanto a wurtzite possui cristais branco-acinzentados..

O sulfeto de zinco é insolúvel em água. Pode causar danos ambientais, pois penetra no solo e contamina os lençóis freáticos e suas correntes.
O sulfeto de zinco pode ser produzido, entre outras reações, por corrosão e por neutralização.
Por corrosão:
Zn + HdoisS => ZnS + Hdois
Por neutralização:
HdoisS + Zn (OH)dois => ZnS + 2HdoisOU
O sulfeto de zinco é um sal fosforescente, o que lhe confere a capacidade de múltiplos usos e aplicações. Além disso, é um semicondutor e fotocatalisador.
Índice do artigo
- 1 Estrutura
- 1.1 Mistura de zinco
- 1,2 Wurzita
- 2 propriedades
- 2.1 Cor
- 2.2 Ponto de fusão
- 2.3 Solubilidade em água
- 2.4 Solubilidade
- 2,5 Densidade
- 2.6 Dureza
- 2.7 Estabilidade
- 2.8 Decomposição
- 3 Nomenclatura
- 3.1 Nomenclaturas sistemáticas e tradicionais
- 4 usos
- 4.1 Como pigmentos ou revestimentos
- 4.2 Por causa de sua fosforescência
- 4.3 Semicondutor, fotocatalisador e catalisador
- 5 referências
Estrutura
O sulfeto de zinco adota estruturas cristalinas governadas por atrações eletrostáticas entre o cátion Zndois+ e o ânion Sdois-. São dois: esfalerita ou blenda de zinco e wurzita. Em ambos, os íons minimizam as repulsões entre íons de cargas iguais..
A mistura de zinco é a mais estável nas condições terrestres de pressão e temperatura; e wurzita, que é menos densa, resulta do rearranjo cristalino devido ao aumento da temperatura.
As duas estruturas podem coexistir no mesmo sólido ZnS ao mesmo tempo, embora, muito lentamente, o wurzita acabe dominando..
Blenda de zinco

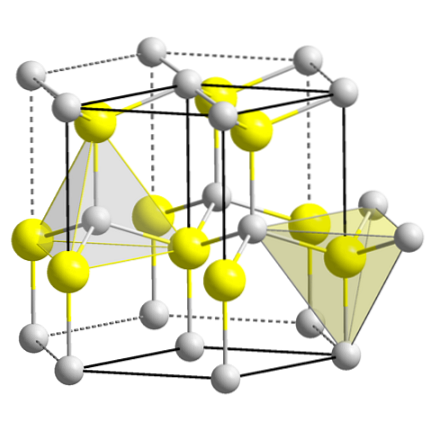
A imagem superior mostra a célula unitária cúbica centrada nas faces da estrutura da mistura de zinco. As esferas amarelas correspondem aos ânions Sdois-, e os cinzas para os cátions Zndois+, localizado nos cantos e no centro das faces do cubo.
Observe as geometrias tetraédricas em torno dos íons. A mistura de zinco também pode ser representada por esses tetraedros, cujos orifícios dentro do cristal possuem a mesma geometria (orifícios tetraédricos)..
Da mesma forma, dentro das células unitárias, a proporção de ZnS é satisfeita; ou seja, uma proporção de 1: 1. Assim, para cada cátion Zndois+ existe um ânion Sdois-. Na imagem pode parecer que abundam as esferas cinzentas, mas na realidade, por se encontrarem nos cantos e no centro das faces do cubo, são partilhadas por outras células..
Por exemplo, se você pegar as quatro esferas amarelas que estão dentro da caixa, as “peças” de todas as esferas cinzas ao redor devem ser iguais (e são) quatro. Assim, na célula unitária cúbica, existem quatro Zndois+ e quatro Sdois-, cumprindo a razão estequiométrica ZnS.
Também é importante enfatizar que existem orifícios tetraédricos na frente e atrás das esferas amarelas (o espaço que as separa umas das outras).
Wurzita
Ao contrário da estrutura da blenda de zinco, a wurzita adota um sistema de cristal hexagonal (imagem superior). Isso é menos compacto, então o sólido tem uma densidade mais baixa. Os íons em wurzita também têm arredores tetraédricos e uma proporção de 1: 1 que concorda com a fórmula ZnS..
Propriedades
Cor
Pode ser apresentado de três maneiras:
-Wurtzita, com cristais brancos e hexagonais.
-Esfalerita, com cristais branco-acinzentados e cristais cúbicos.
-Como um pó branco a branco-acinzentado ou amarelado, e cristais cúbicos amarelados.
Ponto de fusão
1700º C.
Solubilidade em água
Praticamente insolúvel (0,00069 g / 100 ml a 18º C).
Solubilidade
Insolúvel em álcalis, solúvel em ácidos minerais diluídos.
Densidade
Esfalerita 4,04 g / cm3 e wurtzite 4,09 g / cm3.
Dureza
Tem uma dureza de 3 a 4 na escala de Mohs.
Estabilidade
Quando contém água, oxida lentamente em sulfato. Em um ambiente seco é estável.
Decomposição
Quando aquecido a altas temperaturas emite vapores tóxicos de óxidos de zinco e enxofre.
Nomenclatura
A configuração eletrônica do Zn é [Ar] 3d104sdois. Ao perder os dois elétrons do orbital 4s, ele permanece como o cátion Zndois+ com seus orbitais d preenchidos. Portanto, uma vez que eletronicamente Zndois+ é muito mais estável do que o Zn+, tem apenas uma valência de +2.
Portanto, é omitido para a nomenclatura de estoque, acrescentando sua valência entre parênteses e com algarismos romanos: sulfeto de zinco (II).
Nomenclaturas sistemáticas e tradicionais
Mas existem outras maneiras de chamar o ZnS além do já gerado. Na sistemática, o número de átomos de cada elemento é especificado com os numeradores gregos; com a única exceção do elemento à direita quando é apenas um. Assim, o ZnS é denominado como: macacosulfeto de zinco (e não monossulfeto de monozinco).
Em relação à nomenclatura tradicional, o zinco com uma valência única de +2 é adicionado ao adicionar o sufixo -ico. Consequentemente, seu nome tradicional resulta: sulfeto de zincoico.
Formulários
Como pigmentos ou revestimentos
-Sachtolith é um pigmento branco feito com sulfeto de zinco. Usado em calafetagens, mástiques, selantes, subcapas, tintas látex e sinalização.
Seu uso em combinação com pigmentos de absorção de luz ultravioleta, como microtitânio ou pigmentos de óxido de ferro transparente, é necessário em pigmentos resistentes às intempéries.
-Quando o ZnS é aplicado em látex ou tintas texturizadas, ele tem uma ação microbicida prolongada.
-Devido à sua grande dureza e resistência à quebra, erosão, chuva ou poeira, torna-o adequado para janelas de infravermelho externas ou em estruturas de aeronaves.
-O ZnS é utilizado no revestimento de rotores utilizados no transporte de compostos, para reduzir o desgaste. Também é utilizado na produção de tintas de impressão, compostos isolantes, pigmentação termoplástica, plásticos ignífugos e lâmpadas eletroluminescentes..
-O sulfeto de zinco pode ser transparente e pode ser usado como uma janela para óptica visível e óptica infravermelha. Usado em dispositivos de visão noturna, telas de televisão, telas de radar e revestimentos fluorescentes.
-ZnS com dopagem de Cu é usado na produção de painéis de eletroluminescência. Além disso, é usado em propulsão de foguetes e gravimetria.
Por sua fosforescência
-Sua fosforescência é usada para colorir os ponteiros do relógio e, assim, exibir a hora no escuro; também em tintas para brinquedos, em sinais de emergência e avisos de trânsito.
A fosforescência permite o uso de sulfeto de zinco em tubos de raios catódicos e telas de raios-X para brilhar em pontos escuros. A cor da fosforescência depende do ativador usado.
Semicondutor, fotocatalisador e catalisador
-Sphalerite e wurtzite são semicondutores de fenda de banda larga. Sphalerite tem uma fenda de banda de 3,54 eV, enquanto wurtzite tem uma fenda de banda de 3,91 eV.
-O ZnS é utilizado na preparação de um fotocatalisador composto por CdS - ZnS / zircônio - fosfato de titânio utilizado para a produção de hidrogênio sob luz visível.
-Atua como um catalisador para a degradação de poluentes orgânicos. Utilizado na preparação de um sincronizador de cores em lâmpadas LED.
-Seus nanocristais são usados para detecção ultrassensível de proteínas. Por exemplo, emitindo luz de pontos quânticos de ZnS. É usado na preparação de um fotocatalisador combinado (CdS / ZnS) -TiO2 para produção elétrica via fotoeletrocatálise.
Referências
- PubChem. (2018). Sulfeto de zinco. Retirado de: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16 de janeiro). Pigmento Branco à base de Sulfeto de Zinco. Recuperado de: quiminet.com
- Wikipedia. (2018). Sulfeto de zinco. Retirado de: en.wikipedia.org
- II-VI UK. (2015). Sulfeto de zinco (ZnS). Retirado de: ii-vi.es
- Rob Toreki. (2015, 30 de março). A estrutura do Zincblende (ZnS). Retirado de: ilpi.com
- Chemistry LibreTexts. (22 de janeiro de 2017). Estrutura-Zinco Blende (ZnS). Retirado de: chem.libretexts.org
- Reade. (2018). Sulfeto de Zinco / Sulfeto de Zinco (ZnS). Retirado de: reade.com

Ainda sem comentários