
Estrutura, propriedades e usos do sulfeto de prata (Ag2S)
O sulfeto de prata é um composto inorgânico cuja fórmula química é AgdoisS. Consiste em um sólido preto acinzentado formado por cátions Ag+ e S ânionsdois- em uma proporção de 2: 1. O Sdois- é muito parecido com Ag+, porque ambos são íons macios e conseguem se estabilizar um com o outro.
Ornamentos de prata tendem a escurecer, perdendo seu brilho característico. A mudança de cor não é um produto da oxidação da prata, mas de sua reação com o sulfeto de hidrogênio presente no meio ambiente em baixas concentrações; isso pode vir do apodrecimento ou degradação de plantas, animais ou alimentos ricos em enxofre.

O HdoisS, cuja molécula carrega um átomo de enxofre, reage com a prata de acordo com a seguinte equação química: 2Ag (s) + HdoisS (g) => AgdoisS (s) + Hdois(g)
Portanto, o AgdoisS é responsável pelas camadas pretas formadas na prata. Porém, na natureza este sulfeto também pode ser encontrado nos minerais Acantita e Argentita. Os dois minerais se distinguem de muitos outros por seus cristais pretos brilhantes, como o do sólido da imagem acima..
O AGdoisS possui estruturas polimórficas, atrativas propriedades eletrônicas e optoeletrônicas, é um semicondutor e promete ser um material para a fabricação de dispositivos fotovoltaicos, como as células solares..
Índice do artigo
- 1 Estrutura
- 2 propriedades
- 2.1 Peso molecular
- 2.2 Aparência
- 2.3 Odor
- 2.4 Ponto de fusão
- 2,5 Solubilidade
- 2.6 Estrutura
- 2.7 Índice de refração
- 2.8 Constante dielétrica
- 2.9 Eletrônica
- 2.10 Reação de redução
- 3 Nomenclatura
- 3.1 Sistemática
- 3.2 Estoque
- 3.3 Tradicional
- 4 usos
- 5 referências
Estrutura
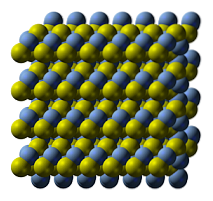
A imagem superior ilustra a estrutura cristalina do sulfeto de prata. As esferas azuis correspondem aos Ag cations+, enquanto os amarelos para os ânions Sdois-. O AGdoisS é polimórfico, o que significa que pode adotar vários sistemas de cristal sob certas condições de temperatura..
Como? Por meio de uma transição de fase. Os íons são rearranjados de forma que o aumento da temperatura e as vibrações do sólido não perturbem o equilíbrio de atração-repulsão eletrostática. Quando isso acontece, diz-se que há uma transição de fase, e o sólido, portanto, exibe novas propriedades físicas (como brilho e cor)..
O AGdoisS em temperaturas normais (abaixo de 179ºC), possui estrutura cristalina monoclínica (α- AgdoisS). Além desta fase sólida, existem duas outras: a bcc (cúbica centrada no corpo) entre 179 a 586ºC, e a fcc (cúbica centrada nas faces) em temperaturas muito altas (δ- AgdoisS).
O mineral argentita consiste na fase fcc, também conhecida como β-AgdoisS. Uma vez resfriado e transformado em acantita, suas características estruturais prevalecem combinadas. Portanto, ambas as estruturas cristalinas coexistem: a monoclínica e a bcc. Assim, surgem sólidos pretos com conotações brilhantes e interessantes..
Propriedades
Peso molecular
247,80 g / mol
Aparência
Cristais pretos acinzentados
Odor
Banheiro.
Ponto de fusão
836 ° C Este valor concorda com o fato de AgdoisS é um composto com pouco caráter iônico e, portanto, derrete em temperaturas abaixo de 1000ºC.
Solubilidade
Na água apenas 6,21 ∙ 10-quinze g / L a 25 ° C. Ou seja, a quantidade de sólido preto que é solubilizado é insignificante. Isso, novamente, é devido ao caráter polar baixo da ligação Ag-S, onde não há diferença significativa na eletronegatividade entre os dois átomos..
Além disso, o AgdoisS é insolúvel em todos os solventes. Nenhuma molécula pode separar com eficiência suas camadas cristalinas em íons Ag+ e Sdois- solvatado.
Estrutura
Na imagem da estrutura você também pode ver quatro camadas de ligações S-Ag-S, que se movem umas sobre as outras quando o sólido é submetido à compressão. Esse comportamento significa que, apesar de ser um semicondutor, é dúctil como muitos metais em temperatura ambiente..
As camadas S-Ag-S se encaixam corretamente devido às suas geometrias angulares, que são vistas como um zigue-zague. Como existe uma força de compressão, eles se movem em um eixo de deslocamento, causando novas interações não covalentes entre os átomos de prata e enxofre..
Índice de refração
2,2
Constante dielétrica
6
Eletrônico
O AGdoisS é um semicondutor anfotérico, ou seja, se comporta como se fosse do tipo n e do tipo p. Além disso, não é frágil, por isso tem sido estudado para sua aplicação em dispositivos eletrônicos..
Reação de redução
O AGdoisS pode ser reduzido a prata metálica banhando as peças pretas com água quente, NaOH, alumínio e sal. A seguinte reação ocorre:
3AgdoisS (s) + 2Al (s) + 3HdoisO (l) => 6Ag (s) + 3HdoisS (ac) + AldoisOU3(s)
Nomenclatura
Prata, cuja configuração eletrônica é [Kr] 4d105s1, ele pode perder apenas um elétron: seu orbital externo 5s. Assim, o cátion Ag+ fica com uma configuração de elétron [Kr] 4d10. Portanto, ele tem uma valência única de +1, que determina como seus compostos devem ser chamados..
O enxofre, por outro lado, possui configuração eletrônica [Ne] 3sdois3p4, e são necessários dois elétrons para completar seu octeto de valência. Quando ele ganha esses dois elétrons (da prata), ele se transforma no ânion sulfeto, Sdois-, com configuração [Ar]. Ou seja, é isoeletrônico para o gás nobre argônio.
Então o AgdoisS deve ser chamado de acordo com as seguintes nomenclaturas:
Sistemático
Macacosulfeto de deramprata. Aqui, o número de átomos de cada elemento é considerado e eles são marcados com os prefixos dos numeradores gregos.
Estoque
Sulfeto de prata. Como tem uma valência única de +1, não é especificado com algarismos romanos entre parênteses: sulfeto de prata (I); o que está errado.
Tradicional
Sulfeto de prataico. Como a prata "funciona" com valência +1, o sufixo -ico é adicionado ao seu nome. argentum Em latim.
Formulários
Alguns dos novos usos de AgdoisS são os seguintes:
-As soluções coloidais de suas nanopartículas (com diferentes tamanhos), possuem atividade antibacteriana, não são tóxicas, podendo, portanto, ser utilizadas nas áreas de medicina e biologia..
-Suas nanopartículas podem formar o que é conhecido como pontos quânticos. Eles absorvem e emitem radiação com maior intensidade do que muitas moléculas orgânicas fluorescentes, de modo que podem substituir as últimas como marcadores biológicos.
-As estruturas de α-AgdoisS faz com que exiba propriedades eletrônicas marcantes para serem usadas como células solares. Da mesma forma, representa um ponto de partida para a síntese de novos materiais e sensores termoelétricos..
Referências
- Mark Peplow. (17 de abril de 2018). O sulfeto de prata semicondutor se estende como metal. Retirado de: cen.acs.org
- Colaboração: Autores e editores da estrutura cristalina dos volumes III / 17E-17F-41C () sulfeto de prata (Ag2S). Em: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein - Grupo III Condensed Matter (Dados Numéricos e Relações Funcionais em Ciência e Tecnologia), vol 41C. Springer, Berlim, Heidelberg.
- Wikipedia. (2018). Sulfeto de prata. Retirado de: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Julho de 2016). AgdoisNanopartículas de sulfeto de prata S e soluções coloidais: Síntese e propriedades. Retirado de: sciencedirect.com
- Materiais Azo. (2018). Sulfeto de prata (AgdoisS) Semicondutores. Retirado de: azom.com
- A. Nwofe. (2015). Perspectivas e desafios dos filmes finos de sulfeto de prata: uma revisão. Divisão de Ciência de Materiais e Energia Renovável, Departamento de Física Industrial, Universidade Estadual de Ebonyi, Abakaliki, Nigéria.
- UMassAmherst. (2011). Demonstrações de palestras: limpeza de prata manchada. Retirado de: lecturedemos.chem.umass.edu
- Estudar. (2018). O que é sulfeto de prata? - Fórmula Química e Usos. Retirado de: study.com



Ainda sem comentários