
Redução (química) em que consiste e exemplos

O redução É toda aquela reação química em que os átomos de um dos reagentes acabam ganhando elétrons; O que também pode ser visto desta forma: sua vaga ou “desconforto” eletrônico é reduzido. Um átomo ganha elétrons quando uma espécie os doa; isto é, enferruja.
Esse tipo de reação não pode acontecer por si só: se uma espécie aceita os elétrons, outra necessariamente deve abandoná-los. Caso contrário, a matéria estaria sendo criada do nada, reduzindo os átomos após ganhar elétrons do vácuo. Portanto, é uma meia reação redox (redução / oxidação).
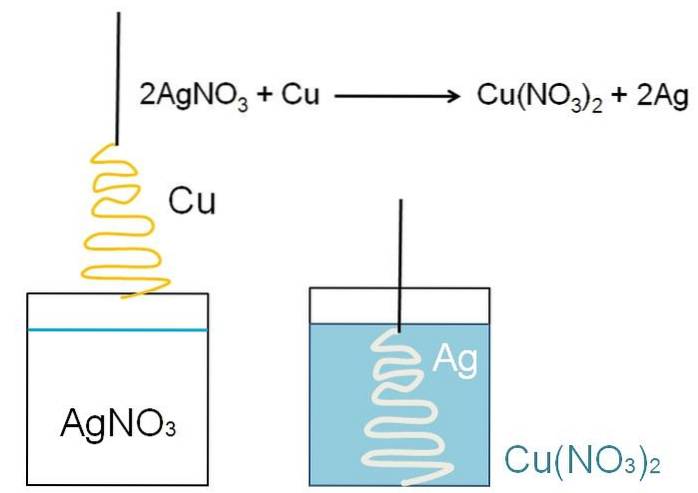
Um exemplo ilustrativo da redução que pode ser mostrada em salas de aula é a reação entre uma superfície metálica de cobre e uma solução aquosa de nitrato de prata, AgNO3.
Em solução, a prata é encontrada como cátions Ag+, carregado positivamente. Estes, ao interagirem com a superfície do cobre, em forma de árvore de Natal, arrebatam os elétrons dos átomos de cobre. Quando isso ocorre, o cobre substitui a prata no sal nitrato; e como resultado, nitrato de cobre, Cu (NO3)dois.
Cu caçõesdois+ próximo a NÃO3- tornar a solução azulada; e prata, embranquece a árvore de Natal como se a cobrisse de neve.
Índice do artigo
- 1 Qual é a redução?
- 1.1 Quantidade de oxigênio
- 1,2 átomo eletronegativo
- 2 exemplos
- 2.1 Redução na química orgânica
- 2.2 Extração de metal
- 3 referências
Qual é a redução?
Em redução, já foi dito que uma espécie ganha elétrons. Como isso pode ser verificado em uma equação química? Por exemplo, na equação para a reação entre Cu e AgNO3, Como saber quando ocorre a redução? Para verificar isso, é necessário determinar o número ou estado de oxidação.
Os elementos em seus estados naturais, têm por definição um estado de oxidação igual a zero, uma vez que se assume que eles não perderam nem ganharam elétrons. Assim, os metais sólidos têm estado de oxidação zero. Assim, a prata vai de +1 (Ag+) a 0 (Ag). A carga de um íon metálico é igual ao seu estado de oxidação.
Por outro lado, os elétrons vieram do cobre: indo de 0 (Cu) a +2 (Cudois+) Ânion nitrato, NÃO3- permanece inalterado enquanto ambos os metais trocam elétrons; portanto, a equação pode ser escrita como:
2Ag+ + Cu => 2Ag + Cudois+
Observe que as cargas e os átomos estão equilibrados..
É nisso que consiste a redução química: no ganho de elétrons que tornam os estados de oxidação dos átomos menos positivos do que os dos elétrons..
Número de oxigênio
Os oxigênios são átomos muito eletronegativos e oxidantes, então, quando um átomo forma compostos com eles (como óxidos), eles têm estados de oxidação positivos. Quanto maior o número de oxigênios interagindo com o átomo, mais positivo será seu estado de oxidação; ou o que é igual, está mais enferrujado.
Portanto, quando um composto tem menos átomos de oxigênio, diz-se que está menos oxidado; ou seja, o átomo perde menos elétrons.
Um exemplo clássico pode ser visto no monóxido de carbono e no dióxido de carbono. Para CO, o carbono tem um estado de oxidação de +2; enquanto para o COdois, seu estado de oxidação é +4.
Então, se em uma reação o COdois se transforma em CO, diz-se que está ocorrendo uma redução; desde então, o carbono agora interage com um oxigênio e não com dois. Para a reação oposta, CO transformando-se em COdois, fala-se de uma oxidação de carbono.
Isso se aplica a todos os átomos, especialmente metais em seus óxidos metálicos; por exemplo, CrOdois (Cr4+) e CrO3 (Cr6+).
Nas equações químicas em que uma espécie perde oxigênio enquanto a outra espécie o ganha, diz-se que ocorre uma transferência de oxigênio.
Átomo eletronegativo
Você sempre pode determinar se houve uma redução alterando o estado de oxidação para um valor menos positivo. Como acabamos de explicar, uma maneira rápida de perceber, mesmo sem fazer as contas, é observar se há uma diminuição nos átomos de oxigênio em um composto..
O mesmo pode acontecer com qualquer outro átomo que seja mais eletronegativo do que o átomo que ganha ou perde elétrons.
Por exemplo, se o CF4 reage de tal forma que se torna CH4, então, diz-se que ocorreu uma redução; já que o flúor é muito mais eletronegativo do que o átomo de hidrogênio. Como resultado, o carbono é menos oxidado no CH4 que no CF4, o que equivale a dizer que foi reduzido.
Exemplos
Redução na química orgânica
O exemplo CF4 e CH4 reflete o que acontece nas reações orgânicas, onde a redução da carga parcial de um átomo é considerada um ganho eletrônico. Isso se aplica muito quando se considera a redução dos grupos funcionais oxigenados..
Por exemplo, considere os grupos ROH, RCHO e COOH. O primeiro corresponde aos álcoois, onde o carbono se liga ao oxigênio (C-OH); o segundo é o grupo aldeído, onde o carbono forma uma ligação dupla com o oxigênio e também está ligado ao hidrogênio (C = O-H); e o terceiro é o grupo carboxila.
No grupo carboxila, o carbono forma uma ligação dupla com um O e uma ligação simples com outro O (HO-C = O).
Portanto, ocorre uma redução se um ácido carboxílico é transformado em um álcool:
RCOOH => ROH
Extração de metal
A redução química é extremamente importante nos processos de extração de metais de seus minerais. Algumas das reações são:
HgS + Odois => Hg + SOdois
O sulfeto de mercúrio é reduzido a mercúrio metálico.
CudoisS + Odois => 2Cu + SOdois
O sulfeto de cobre é reduzido a cobre metálico.
2ZnS + 3Odois => 2ZnO + 2SOdois
ZnO + C => Zn + CO (observe a transferência de O)
O sulfeto de zinco é primeiro reduzido ao seu monóxido e depois à sua forma metálica.
FédoisOU3 + 3CO => 2Fe + 3COdois
O óxido férrico é reduzido a ferro metálico.
OS3 + 3Hdois => W + 3HdoisOU
E o trióxido de tungstênio é reduzido a tungstênio metálico.
Como exercício, o número de oxidação do metal pode ser determinado antes de ser reduzido.
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Chemistry LibreTexts. (9 de dezembro de 2018). Reações de redução de oxidação. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (4 de julho de 2018). A definição de redução em química. Recuperado de: Thoughtco.com
- Hultzman R. (2019). Redução em Química: Definição e Visão Geral. Estudar. Recuperado de: study.com
- Clark J. (2013). Definições de oxidação e redução (redox). Recuperado de: chemguide.co.uk
- Visualização do tutor. (s.f.). Reação de redução. Recuperado de: química.tutorvista.com

Ainda sem comentários