
Características, produtos, exemplos da reação de neutralização

UMA reação neutralizadora É aquele que ocorre entre uma espécie ácida e uma espécie básica de forma quantitativa. Em geral, neste tipo de reação em meio aquoso, água e um sal (espécie iônica composta de um cátion diferente de H+ e um ânion diferente de OH- ou Odois-) de acordo com a seguinte equação: ácido + base → sal + água.
Os eletrólitos têm impacto na reação de neutralização, que são aquelas substâncias que, quando dissolvidas em água, geram uma solução que permite a condutividade elétrica. Ácidos, bases e sais são considerados eletrólitos.

Desta forma, eletrólitos fortes são aquelas espécies que se dissociam completamente em seus íons constituintes quando estão em solução, enquanto eletrólitos fracos são apenas parcialmente ionizados (eles têm uma capacidade menor de conduzir uma corrente elétrica; ou seja, eles não são bons condutores como eletrólitos fortes).
Índice do artigo
- 1 recursos
- 1.1 Titulações ácido-base
- 2 exemplos
- 2.1 Ácido forte + base forte
- 2.2 Ácido forte + base fraca
- 2.3 Ácido fraco + base forte
- 2.4 Ácido fraco + base fraca
- 3 referências
Caracteristicas
Em primeiro lugar, deve-se enfatizar que se uma reação de neutralização for iniciada com quantidades iguais de ácido e base (em moles), ao final da referida reação, apenas um sal é obtido; ou seja, não há quantidades residuais de ácido ou base.
Além disso, uma propriedade muito importante das reações ácido-base é o pH, que indica o quão ácida ou básica é uma solução. Isso é determinado pela quantidade de íons H+ encontrado nas soluções medidas.
Por outro lado, existem vários conceitos de acidez e basicidade dependendo dos parâmetros que são levados em consideração. Um conceito que se destaca é o de Brønsted e Lowry, que consideram o ácido uma espécie capaz de doar prótons (H+) e uma espécie de base capaz de aceitá-los.
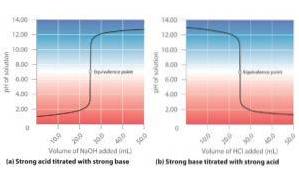
Titulações ácido-base
Para estudar adequada e quantitativamente uma reação de neutralização entre um ácido e uma base, uma técnica chamada titulação ácido-base (ou titulação) é aplicada..
As titulações ácido-base consistem em determinar a concentração de ácido ou base necessária para neutralizar uma certa quantidade de base ou ácido de concentração conhecida.
Na prática, uma solução padrão (cuja concentração é conhecida exatamente) deve ser gradualmente adicionada à solução cuja concentração é desconhecida até que o ponto de equivalência seja alcançado, onde uma das espécies neutralizou completamente a outra..
O ponto de equivalência é detectado pela mudança violenta na cor do indicador que foi adicionado à solução de concentração desconhecida quando a reação química entre as duas soluções foi concluída..
Por exemplo, no caso da neutralização do ácido fosfórico (H3PO4) haverá um ponto de equivalência para cada próton que é liberado do ácido; ou seja, haverá três pontos de equivalência e três mudanças de cor serão observadas.
Produtos de uma reação de neutralização
Nas reações de um ácido forte com uma base forte ocorre a neutralização completa da espécie, como na reação entre o ácido clorídrico e o hidróxido de bário:
2HCl (aq) + Ba (OH)dois(ac) → BaCldois(aq) + 2HdoisO (l)
Portanto, nenhum íon H é gerado+ você OH- em excesso, o que significa que o pH de soluções de eletrólitos fortes que foram neutralizadas está intrinsecamente relacionado ao caráter ácido de seus reagentes.
Pelo contrário, no caso de neutralização entre um eletrólito fraco e um forte (ácido forte + base fraca ou ácido fraco + base forte), a dissociação parcial do eletrólito fraco é obtida e a constante de dissociação do ácido (Kpara) ou a base (Kb) fraco, para determinar o caráter ácido ou básico da reação líquida calculando o pH.
Por exemplo, temos a reação entre o ácido cianídrico e o hidróxido de sódio:
HCN (aq) + NaOH (aq) → NaCN (aq) + HdoisO (l)
Nesta reação, o eletrólito fraco não ioniza visivelmente na solução, então a equação iônica líquida é representada da seguinte forma:
HCN (aq) + OH-(ac) → CN-(ac) + HdoisO (l)
Isto é obtido após escrever a reação com eletrólitos fortes em sua forma dissociada (Na+(ac) + OH-(ac) no lado do reagente, e Na+(ac) + CN-(ac) no lado dos produtos), onde apenas o íon sódio é um espectador.
Finalmente, no caso da reação entre um ácido fraco e uma base fraca, a referida neutralização não ocorre. Isso ocorre porque ambos os eletrólitos se dissociam parcialmente, sem resultar na água e no sal esperados..
Exemplos
Ácido forte + base forte
A dada reação entre ácido sulfúrico e hidróxido de potássio em meio aquoso é tomada como exemplo, de acordo com a seguinte equação:
HdoisSW4(aq) + 2KOH (aq) → KdoisSW4(aq) + 2HdoisO (l)
Pode-se ver que tanto o ácido quanto o hidróxido são eletrólitos fortes; portanto, eles se ionizam completamente em solução. O pH desta solução vai depender do eletrólito forte que está na maior proporção.
Ácido forte + base fraca
A neutralização do ácido nítrico com amônia resulta no nitrato de amônio composto, conforme mostrado abaixo:
HNO3(ac) + NH3(ac) → NH4NÃO3(ac)
Nesse caso, a água produzida junto com o sal não é observada, pois teria que ser representada como:
HNO3(ac) + NH4+(ac) + OH-(ac) → NH4NÃO3(ac) + HdoisO (l)
Portanto, a água pode ser vista como um produto de reação. Neste caso, a solução terá um pH essencialmente ácido.
Ácido fraco + base forte
A reação que ocorre entre o ácido acético e o hidróxido de sódio é mostrada abaixo:
CH3COOH (aq) + NaOH (aq) → CH3COONa (ac) + HdoisO (l)
Como o ácido acético é um eletrólito fraco, ele se dissocia parcialmente, resultando em acetato de sódio e água, cuja solução terá um pH básico..
Ácido fraco + base fraca
Por último e como mencionado anteriormente, uma base fraca não pode neutralizar um ácido fraco; nem o oposto acontece. Ambas as espécies são hidrolisadas em solução aquosa e o pH da solução dependerá da "força" do ácido e da base..
Referências
- Wikipedia. (s.f.). Neutralização (Química). Recuperado de en.wikipedia.org
- Chang, R. (2007). Química, nona edição (McGraw-Hill).
- Raymond, K. W. (2009). Química Orgânica e Biológica Geral. Recuperado de books.google.co.ve
- Joesten, M. D., Hogg, J. L. e Castellion, M. E. (2006). The World of Chemistry: Essentials. Recuperado de books.google.co.ve
- Clugston, M. e Flemming, R. (2000). Química Avançada. Recuperado de books.google.co.ve
- Reger, D. L., Goode, S. R. e Ball, D. W. (2009). Química: Princípios e Prática. Recuperado de books.google.co.ve


Ainda sem comentários