
O que são funções químicas inorgânicas?
As funções químicas inorgânicas são aquelas famílias de compostos inorgânicos que compartilham características químicas semelhantes. Essas funções químicas são compostas por cinco grupos: óxidos, bases ou hidróxidos, ácidos, sais e hidretos..
Cada função química é definida por um conjunto de átomos que os identifica. Desta forma, torna-se possível identificar a função a que pertence um composto químico de acordo com seus elementos..

Nesse sentido, podemos afirmar que o grupo OH define a função química do hidróxido. Portanto, o NaOH (hidróxido de sódio) pertencerá ao grupo dos hidróxidos.
As funções químicas inorgânicas fazem uso de compostos químicos de origem mineral. Sal, água, ouro, chumbo, gesso e talco são alguns exemplos de compostos inorgânicos de uso diário..
Todos os compostos inorgânicos já existiam no planeta Terra antes da origem da vida. Com a teoria atômica, o desenvolvimento da tabela periódica e a radioquímica, foi possível definir as cinco funções da química inorgânica..
As primeiras investigações e abordagens sobre o assunto ocorreram no início do século XIX e basearam-se no estudo de compostos inorgânicos simples (sais e gases)..
Índice do artigo
- 1 funções químicas inorgânicas
- 1.1 - Óxidos
- 1.2 - Bases ou hidróxidos
- 1.3 - Ácidos
- 1.4 - Sais
- 1.5 - Hidretos
- 2 referências
Funções químicas inorgânicas
- Óxidos

Os óxidos são compostos duplos ou binários onde um ou mais átomos de oxigênio são combinados com outros elementos. Por este motivo, existem inúmeros tipos de óxidos em diferentes estados da matéria (sólido, líquido e gasoso).
O oxigênio sempre contribui para um estado de oxidação de -2, e quase todos os elementos que se combinam com ele dão origem a compostos estáveis em diferentes graus de oxidação..
Graças a eles, os compostos obtidos têm propriedades variadas e podem ter ligações iônicas covalentes e sólidas..
Óxidos básicos
Os óxidos básicos são compostos derivados da mistura de oxigênio com um metal (de transição, alcalino-terroso ou alcalino). Por exemplo, combinar magnésio com oxigênio resulta em um óxido básico, como este:
2Mg + O2 → 2 MgO
Metal + oxigênio = óxido básico
2MgO = óxido básico
Nomenclatura
A nomenclatura dos óxidos é sempre a mesma. Primeiro é indicado o nome genérico do composto (óxido), e depois o nome do metal é escrito. Isso acontece enquanto a valência do metal é fixa.
Um exemplo pode ser óxido de sódio ou Na2O, onde o símbolo do metal vai primeiro e depois o do oxigênio com sua valência ou estado de oxidação de -2.
No caso dos óxidos básicos, existem três tipos de nomenclatura: a tradicional, a atômica e a de estoque. O nome de cada óxido básico vai depender da valência ou número de oxidação de cada elemento.
Caracteristicas
- Eles são sempre formados pela combinação de qualquer elemento com oxigênio.
- Óxidos binários são aqueles que são obtidos pela mistura de oxigênio com outro elemento.
- Para obter um óxido ternário ou misto, um composto binário deve ser combinado com água (H2O).
- Existem óxidos mistos resultantes da combinação de dois elementos diferentes com o oxigênio.
- Bases ou hidróxidos

Seu sabor é amargo, sua textura é ensaboada ao toque, são bons condutores de corrente elétrica quando em solução aquosa, são corrosivos e quando tocam o papel de tornassol o transformam do rosa ao azul..
Caracteristicas
- Eles são derivados da mistura de um óxido básico com água.
- As substâncias que eles criam podem receber prótons.
- Eles são condutores de eletricidade chamados eletrólitos.
- Eles são solúveis em água quando entram em contato com ela.
- Seu sabor é amargo.
- Eles são corrosivos para a pele.
- Ácidos

Ácidos são compostos inorgânicos que resultam da mistura de hidrogênio com qualquer elemento ou grupo de elementos com alta eletronegatividade.
Eles podem ser facilmente identificados por seu sabor ácido, porque podem queimar a pele quando entram em contato direto com ela e por causa de sua capacidade de mudar a cor do papel de tornassol de azul para rosa..
Hidrácidos
Hidrácidos são um grupo de ácidos derivados da combinação de hidrogênio com um não-metal. Um exemplo pode ser a combinação de cloro com hidrogênio que resulta em ácido clorídrico, como este:
Cl2 + H2 → 2HCL
Não metal + hidrogênio = hidrácido
H2CL = hidrácido
Oxácidos
Oxácidos são um grupo de ácidos derivados da combinação de água com um óxido de ácido. Um exemplo pode ser a combinação de trióxido de enxofre com água que resulta em ácido sulfúrico, como este:
SO3 + H2O → H2SO4
Óxido ácido + água = óxido
H2SO4 = Oxido
Caracteristicas
- Eles queimam a pele porque são corrosivos.
- Seu sabor é azedo.
- Eles são condutores de corrente elétrica.
- Ao reagir com uma base, eles formam um sal e água.
- Ao reagir com um óxido de metal, eles formam um sal e água.
- Você sai
Os sais são compostos derivados da combinação de uma base com um ácido. Eles geralmente têm um sabor salgado e estão em um estado ácido.
Eles são bons condutores elétricos em soluções aquosas. O contato com o papel de tornassol não afeta sua cor.
Haloides
Os sais haloides são aqueles que carecem de oxigênio e são formados pelas seguintes reações:
1 - Quando misturado com um metal halógeno. Um exemplo pode ser a combinação de magnésio com ácido clorídrico para formar cloreto de magnésio e hidrogênio, como este:
Mg + 2HCl → MgCl2 + H2
2 - Ao misturar um metal ativo com um hidrácido. Um exemplo pode ser a combinação de ácido bromídrico com óxido de sódio, que resulta em brometo de sódio e água, como este:
2HBr + 2NaO 2 → NaBr + H2O
3 - Ao misturar um hidrácido com um óxido metálico. Um exemplo pode ser a combinação de ácido clorídrico com hidróxido de sódio para formar cloreto de sódio e água, como este:
HCl + NaOH → NaCl + H2O
- Oxisales

Oxisais são os sais que contêm oxigênio. Eles são formados da seguinte forma:
1 - Ao misturar um hidrácido com um hidróxido. Este é um processo de neutralização. Um exemplo pode ser a mistura de magnésio com ácido sulfúrico para formar sulfato de magnésio e água, como este:
Mg + H2SO4 → MgSO4 + H2O
2 - Ao misturar um oxácido com um metal ativo. Um exemplo pode ser a combinação de hidróxido de cálcio com dióxido de carbono para dar carbonato de cálcio e água, como este:
Ca (OH) 2 + CO2 → CaCO3 + H2O
3 - Ao misturar um hidróxido com um anidrido.
4 - Ao misturar um hidróxido com um oxácido. Um exemplo pode ser a combinação de ácido nítrico com hidróxido de bário para dar nitrato de bário e água, como este:
2HNO3 + Ba (OH) 2 → Ba (NO3) 2 + 2H2O
Caracteristicas
- Eles têm um gosto salgado.
- Eles podem ser ácidos ou básicos.
- Eles são bons condutores elétricos.
- Hidretos
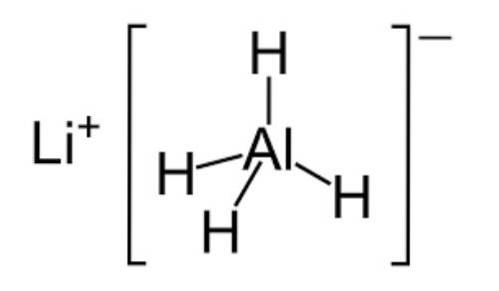
Hidretos são compostos químicos inorgânicos feitos de hidrogênio e qualquer elemento não metálico.
Eles geralmente estão no estado gasoso e têm propriedades semelhantes às dos ácidos. No entanto, existem certos hidretos especiais, como a água (H2O), que podem estar no estado líquido à temperatura ambiente..
Nomenclatura
Para formular um hidreto, primeiro escreva o símbolo para o hidrogênio e depois para o elemento.
Para nomeá-los, o sufixo uro e a raiz do não metal são adicionados, especificando a presença de hidrogênio. Alguns exemplos são os seguintes:
HF = fluoreto de hidrogênio
HCl = cloreto de hidrogênio
HBr = brometo de hidrogênio
Referências
- (21 de novembro de 2011). BuenasTareas.com. Obtido de óxidos, ácidos, hidróxidos, sais halóide, etc: goodtasks.com.
- García, R. E. (2007). Funções químicas inorgânicas e sua nomenclatura. Trillas editoriais.
- House, J. E., & House, K. A. (2016). Química Inorgânica Descritiva. Londres: Elsevier.
- Vasquez, L. N., & Blanco, W. Y. (25 de abril de 2013). Química. Obtido de Óxidos, Hidróxidos, Ácidos e Sais: quimicanataliamywendyd.blogspot.com.
- Williams, A. (1979). Uma abordagem teórica para a química inorgânica. Berlim: Springer - Verlag.

Ainda sem comentários