
Quais são as forças de Van der Waals?
As Forças de Van der Waals são forças intermoleculares de natureza elétrica que podem ser atrativas ou repulsivas. Existe uma interação entre as superfícies das moléculas ou átomos, diferente em essência das ligações iônicas, covalentes e metálicas que se formam no interior das moléculas..
Embora fracas, essas forças são capazes de atrair moléculas de gás; também a dos gases liquefeitos e solidificados e de todos os líquidos e sólidos orgânicos. Johannes Van der Waals (1873) foi quem desenvolveu uma teoria para explicar o comportamento de gases reais.

Na chamada equação de Van der Waals para gases reais - (P + parandois/ Vdois) (V - nb)) = nRT- duas constantes são introduzidas: a constante b (ou seja, o volume ocupado pelas moléculas de gás) e “a”, que é uma constante empírica.
A constante “a” corrige o desvio do comportamento esperado dos gases ideais em baixas temperaturas, justamente onde se expressa a força de atração entre as moléculas do gás. A capacidade de um átomo de polarizar na tabela periódica aumenta do topo de um grupo para a parte inferior do grupo e da direita para a esquerda ao longo de um período..
Ao aumentar o número atômico - e, portanto, o número de elétrons - aqueles que estão localizados nas camadas externas são mais fáceis de mover para formar elementos polares.
Índice do artigo
- 1 Interações elétricas intermoleculares
- 1.1 Interação entre dipolos permanentes
- 1.2 Interação entre um dipolo permanente e um dipolo induzido
- 2 forças ou dispersão de Londres
- 3 rádios Van der Waals
- 4 Forças e energia da interação elétrica entre átomos e entre moléculas
- 5 referências
Interações elétricas intermoleculares
Interação entre dipolos permanentes
Existem moléculas eletricamente neutras, que são dipolos permanentes. Isso se deve a um distúrbio na distribuição eletrônica que produz uma separação espacial das cargas positivas e negativas em direção às extremidades da molécula, constituindo um dipolo (como se fosse um ímã).
A água é composta por 2 átomos de hidrogênio em uma extremidade da molécula e um átomo de oxigênio na outra extremidade. O oxigênio tem uma afinidade maior com os elétrons do que o hidrogênio e os atrai.
Isso produz um deslocamento de elétrons em direção ao oxigênio, deixando este com carga negativa e o hidrogênio com carga positiva..

A carga negativa de uma molécula de água pode interagir eletrostaticamente com a carga positiva de outra molécula de água, causando uma atração elétrica. Assim, este tipo de interação eletrostática é chamada de forças de Keesom.
Interação entre um dipolo permanente e um dipolo induzido
O dipolo permanente tem o que é chamado de momento de dipolo (µ). A magnitude do momento dipolo é dada pela expressão matemática:
µ = q.x
q = carga elétrica.
x = distância espacial entre os pólos.
O momento de dipolo é um vetor que, por convenção, é representado orientado do polo negativo ao positivo. A magnitude de µ dói para expressar em debye (3,34 × 10-30 Cm.
O dipolo permanente pode interagir com uma molécula neutra causando uma alteração em sua distribuição eletrônica, resultando em um dipolo induzido nesta molécula..
O dipolo permanente e o dipolo induzido podem interagir eletricamente, produzindo uma força elétrica. Esse tipo de interação é conhecido como indução e as forças que agem sobre ele são chamadas de forças de Debye..
Forças de Londres ou dispersão
A natureza dessas forças atrativas é explicada pela mecânica quântica. London postulou que, em um instante, em moléculas eletricamente neutras, o centro das cargas negativas dos elétrons e o centro das cargas positivas dos núcleos podem não coincidir..
Assim, a flutuação da densidade do elétron permite que as moléculas se comportem como dipolos temporários.
Isso não é, por si só, uma explicação para as forças de atração, mas dipolos temporários podem induzir polarização adequadamente alinhada de moléculas adjacentes, resultando na geração de uma força de atração. As forças de atração geradas por flutuações eletrônicas são chamadas de forças de Londres ou dispersão..
As forças de Van der Waals mostram anisotropia, razão pela qual são influenciadas pela orientação das moléculas. No entanto, as interações do tipo dispersão são sempre predominantemente atraentes..
As forças de Londres ficam mais fortes à medida que o tamanho das moléculas ou átomos aumenta.
Em halogênios, as moléculas Fdois e Cldois números atômicos baixos são gases. O BRdois com o maior número atômico é um líquido e o Idois, o halogênio com o maior número atômico é um sólido à temperatura ambiente.
Aumentar o número atômico aumenta o número de elétrons presentes, o que facilita a polarização dos átomos e, portanto, as interações entre eles. Isso determina o estado físico dos halogênios.
Rádios Van der Waals
As interações entre moléculas e entre átomos podem ser atrativas ou repulsivas, dependendo de uma distância crítica entre seus centros, que é chamada de rv.
Em distâncias entre moléculas ou átomos maiores que rv, a atração entre os núcleos de uma molécula e os elétrons da outra predomina sobre as repulsões entre os núcleos e os elétrons das duas moléculas.
No caso descrito, a interação é atrativa, mas o que acontece se as moléculas se aproximarem a uma distância entre seus centros menor que rv? Então, a força repulsiva predomina sobre a atrativa, que se opõe a uma aproximação mais próxima entre os átomos..
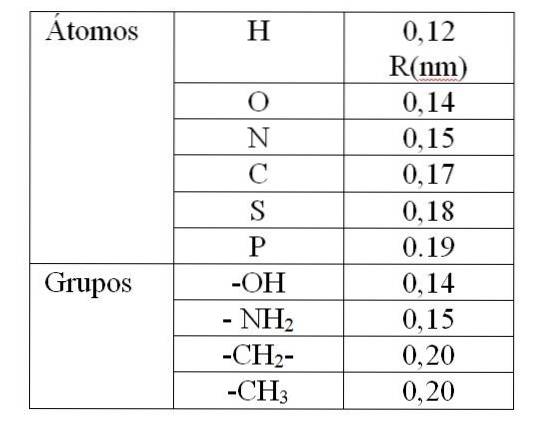
O valor de rv É dado pelos chamados raios de Van der Waals (R). Para moléculas esféricas e idênticas rv é igual a 2R. Para duas moléculas diferentes de raios R1 e Rdois: rv é igual a R1 + Rdois. Os valores dos raios de Van der Waals são dados na tabela 1.
O valor dado na Tabela 1 indica um raio de Van der Waals de 0,12 nm (10-9 m) para hidrogênio. Então o valor de rv para este átomo é 0,24 nm. Para um valor de rv menos de 0,24 nm irá produzir uma repulsão entre os átomos de hidrogênio.
Forças e energia da interação elétrica entre átomos e entre moléculas
A força entre um par de cargas q1 e quedois, separados no vácuo pela distância r, é dada pela lei de Coulomb.
F = k. o que1.o quedois/ rdois
Nesta expressão, k é uma constante cujo valor depende das unidades utilizadas. Se o valor da força - dado pela aplicação da lei de Coulomb - for negativo, indica uma força atrativa. Pelo contrário, se o valor dado para a força for positivo, é indicativo de uma força repulsiva.
Como as moléculas geralmente estão em um meio aquoso que protege as forças elétricas exercidas, é necessário introduzir o termo constante dielétrica (ε). Assim, esta constante corrige o valor dado para as forças elétricas pela aplicação da lei de Coulomb.
F = k.q1.o quedois/ε.rdois
Da mesma forma, a energia para a interação elétrica (U) é dada pela expressão:
U = k. o que1.o quedois/ε.r
Referências
- Os editores da Encyclopaedia Britannica. (2018). Forças de Van der Waals. Obtido em 27 de maio de 2018, em: britannica.com
- Wikipedia. (2017). Forças de Van der Waals. Obtido em 27 de maio de 2018, em: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Forças de Van der waals. Obtido em 27 de maio de 2018, em: chem.libretexts.org
- Morris, J. G. (1974) A Biologist's Physical Chemistry. 2ª edição. Edward Arnold (Publishers) Limited.
- Mathews, C. K., Van Holde, K.E. e Ahern, K.G. (2002) Biochemistry. Terceira edição. Addison Wesley Longman, Inc.



Ainda sem comentários