
O que é uma solução saturada? (com exemplos)

UMA solução saturada É uma solução química que contém a concentração máxima de soluto dissolvido em um solvente. É considerado um estado de equilíbrio dinâmico onde as velocidades em que o solvente dissolve o soluto e a velocidade de recristalização são iguais (J., 2014).
O soluto adicional não se dissolverá em uma solução saturada e aparecerá em uma fase diferente, seja um precipitado se for um sólido em líquido ou uma efervescência se for um gás em um líquido (Anne Marie Helmenstine, 2016).
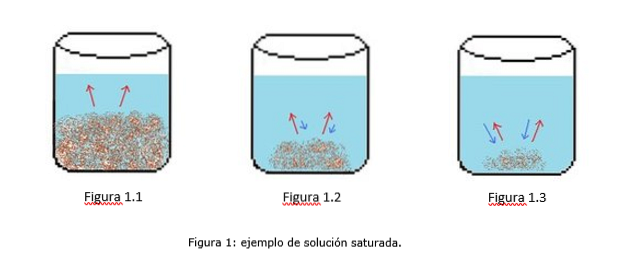
Um exemplo de uma solução saturada é ilustrado na Figura 1. Nas Figuras 1.1, 1.2 e 1.3, há um volume constante de água no copo. Na figura 1.1 começa o processo de saturação, onde o soluto começa a se dissolver, representado pelas setas vermelhas.
Na Figura 1.2, grande parte do sólido se dissolveu, mas não completamente devido ao processo de recristalização, representado pelas setas azuis..
Na Figura 1.3, apenas uma pequena quantidade de soluto permanece não dissolvida. Nesse caso, a taxa de recristalização é maior do que a taxa de dissolução. (pontas de saturação, 2014)
O ponto de concentração máxima de um soluto em um solvente é conhecido como ponto de saturação.
Índice do artigo
- 1 Fatores que afetam a saturação
- 1.1 Temperatura
- 1.2 Pressão
- 1.3 Composição Química
- 1.4 Fatores mecânicos
- 2 Curvas de saturação e solubilidade
- 3 Exemplos de soluções saturadas
- 4 O que é uma solução supersaturada?
- 5 referências
Fatores que afetam a saturação
A quantidade de soluto que pode ser dissolvido em um solvente dependerá de diferentes fatores, entre eles os mais importantes são:
Temperatura
A solubilidade aumenta com a temperatura. Por exemplo, mais sal pode ser dissolvido em água quente do que em água fria..
No entanto, pode haver exceções, por exemplo, a solubilidade dos gases na água diminui com o aumento da temperatura. Nesse caso, as moléculas de soluto recebem energia cinética à medida que se aquecem, o que facilita seu escape..
Pressão
O aumento da pressão pode forçar a dissolução do soluto. Isso é comumente usado para dissolver gases em líquidos..
Composição química
A natureza do soluto e do solvente e a presença de outros compostos químicos na solução afetam a solubilidade. Por exemplo, mais açúcar pode ser dissolvido na água do que sal na água. Neste caso, diz-se que o açúcar é mais solúvel.
O etanol em água é completamente solúvel entre si. Neste caso particular, o solvente será o composto encontrado em maior quantidade.
Fatores mecânicos
Em contraste com a taxa de dissolução, que depende principalmente da temperatura, a taxa de recristalização depende da concentração de soluto na superfície da rede cristalina, que é favorecida quando uma solução é imóvel.
Portanto, mexendo a solução evita esse acúmulo, maximizando a dissolução (tipes of saturation, 2014).
Curvas de saturação e solubilidade
As curvas de solubilidade são um banco de dados gráfico onde a quantidade de soluto que se dissolve em uma quantidade de solvente é comparada, a uma determinada temperatura.
As curvas de solubilidade são comumente traçadas para uma quantidade de soluto, seja sólido ou gasoso, em 100 gramas de água (Brian, 2014).
A Figura 2 ilustra as curvas de saturação para vários solutos na água..
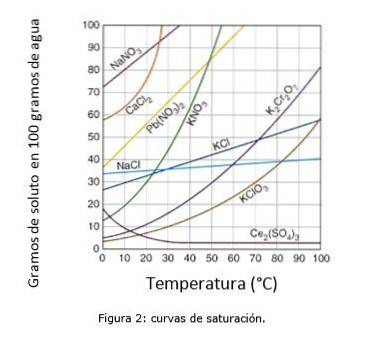
No eixo das coordenadas temos a temperatura em graus centígrados, e no eixo da abscissa temos a concentração de soluto expressa em gramas de soluto por 100 gramas de água.
A curva indica o ponto de saturação em uma determinada temperatura. A área sob a curva indica que você tem uma solução insaturada e, portanto, mais soluto pode ser adicionado..
A área acima da curva possui uma solução supersaturada. (Curvas de solubilidade, n.d.)
Tomando o cloreto de sódio (NaCl) como exemplo, a 25 graus centígrados aproximadamente 35 gramas de NaCl podem ser dissolvidos em 100 gramas de água para se obter uma solução saturada. (Universidade Cambrige, s.f.)
Exemplos de soluções saturadas
Soluções saturadas podem ser encontradas no dia-a-dia, não é necessário estar em laboratório químico. O solvente não precisa ser necessariamente água. Abaixo estão alguns exemplos diários de soluções saturadas:
-Refrigerantes e refrigerantes em geral são soluções saturadas de dióxido de carbono na água. É por isso que, quando a pressão é liberada, bolhas de dióxido de carbono se formam..
-Solos da terra são saturados com nitrogênio.
-Açúcar ou sal podem ser adicionados ao vinagre para formar uma solução saturada..
-Adicione o chocolate em pó ao leite até que ele não se dissolva, forma uma solução saturada.
-O leite pode ser saturado com farinha a tal ponto que não se pode adicionar mais farinha ao leite.
-A manteiga derretida pode ser saturada com sal, quando o sal não mais se dissolver.
O que é uma solução supersaturada?
A definição de uma solução supersaturada é aquela que contém mais soluto dissolvido do que normalmente seria dissolvido no solvente. Isso geralmente é feito aumentando a temperatura da solução..
Uma ligeira alteração da solução ou introdução de uma “semente” ou minúsculo cristal de soluto forçará a cristalização do excesso de soluto. Se não houver ponto de nucleação para a formação de cristais, o excesso de soluto pode permanecer na solução.
Outra forma de supersaturação pode ocorrer quando uma solução saturada é cuidadosamente resfriada. Esta mudança nas condições significa que a concentração é realmente mais alta do que o ponto de saturação, a solução foi supersaturada..
Isso pode ser usado no processo de recristalização para purificar um produto químico: ele se dissolve até o ponto de saturação em solvente quente, então, conforme o solvente esfria e a solubilidade diminui, o excesso de soluto precipita.
As impurezas, que estão presentes em uma concentração muito menor, não saturam o solvente e, portanto, permanecem dissolvidas no líquido.
Referências
- Anne Marie Helmenstine, P. (2016, 7 de julho). Definição e exemplos de solução saturada. Obtido em about: about.com
- Cambrige University. (s.f.). Curvas de solubilidade. Obtido em dynamicscience.com: dynamicscience.com.au.
- Exemplos de solução saturada. (s.f.). Obtido em seu dicionário: exemplos.seu dicionário.com.
- , S. (2014, 4 de junho). Soluções saturadas e supersaturadas. Obtido em socratic.org: socratic.org.
- James, N. (s.f.). Solução saturada: definição e exemplos. Obtido em study.com: study.com.
- , B. (2014, 14 de outubro). Soluções saturadas e supersaturadas. Obtido em socratic.org: socratic.org.
- Curvas de Solubilidade. (s.f.). Obtido em KentChemistry: kentchemistry.com.
- Pontas de saturação. (26 de junho de 2014). Retirado do libretex de química: chem.libretexts.org.


Ainda sem comentários