
O que é uma solução diluída? fatores e exemplos
UMA solução diluída ou insaturadoÉ uma solução química que não atingiu a concentração máxima de soluto dissolvido em um solvente. O soluto adicional se dissolverá quando adicionado a uma solução diluída e não aparecerá na fase aquosa..
Do ponto de vista físico-químico, uma solução insaturada é considerada um estado de equilíbrio dinâmico onde as taxas nas quais o solvente dissolve o soluto são maiores do que a taxa de recristalização..
Um exemplo de uma solução diluída é ilustrado na Figura 1. Na figura 1.1, 1.2 e 1.3, há um volume constante de água no copo.
Na figura 1.1, o processo começa onde o soluto começa a se dissolver, representado pelas setas vermelhas. Neste caso, duas fases são vistas, uma líquida e uma sólida.
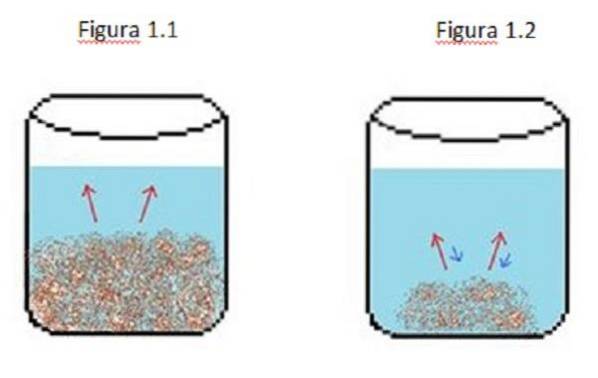
Na Figura 1.2, grande parte do sólido se dissolveu, mas não completamente devido ao processo de recristalização, representado pelas setas azuis..
Neste caso, as setas vermelhas são maiores que as setas azuis, o que significa que a taxa de diluição é maior que a taxa de recristalização. Neste ponto, você tem uma solução insaturada.
Assim, podemos dizer que uma solução diluída pode dissolver mais soluto nela até atingir o ponto de saturação. No ponto de saturação, nenhum soluto mais se dissolverá no solvente e tal solução é chamada de solução saturada..
Desta forma, as soluções são inicialmente insaturadas por natureza e, eventualmente, tornam-se soluções saturadas pela adição de soluto nas mesmas..
O que é uma solução diluída?
Uma solução diluída é aquela solução insaturada, saturada ou supersaturada à qual mais solvente é adicionado. O resultado é uma solução insaturada de menor concentração.
As diluições são um processo comum em um laboratório químico. Em geral, você trabalha com soluções diluídas feitas de soluções de estoque que são adquiridas diretamente de um determinado comerciante.
Para fazer as diluições, a fórmula C é usada1V1= CdoisVdois onde C é a concentração da solução, geralmente em termos de molaridade ou normalidade. V é o volume da solução em ml e os termos 1 e 2 correspondem às soluções concentradas e diluídas, respectivamente.
Fatores que afetam a solubilidade
A quantidade de soluto que pode ser dissolvido em um solvente dependerá de diferentes fatores, entre eles os mais importantes são:
1- Temperatura
A solubilidade aumenta com a temperatura. Por exemplo, mais sal pode ser dissolvido em água quente do que em água fria..
No entanto, pode haver exceções, por exemplo, a solubilidade dos gases na água diminui com o aumento da temperatura..
Nesse caso, as moléculas de soluto recebem energia cinética à medida que se aquecem, o que facilita seu escape..
2- Pressão
O aumento da pressão pode forçar a dissolução do soluto. Isso é comumente usado para dissolver gases em líquidos..
3- Composição Química
A natureza do soluto e do solvente e a presença de outros compostos químicos na solução afetam a solubilidade..
Por exemplo, mais açúcar pode ser dissolvido na água do que sal na água. Neste caso, diz-se que o açúcar é mais solúvel.
O etanol e a água são completamente solúveis um no outro. Neste caso particular, o solvente será o composto encontrado em maior quantidade.
4- Fatores mecânicos
Em contraste com a taxa de dissolução, que depende principalmente da temperatura, a taxa de recristalização depende da concentração de soluto na superfície da rede cristalina, que é favorecida quando uma solução é imóvel.
Portanto, a agitação da solução evita esse acúmulo, maximizando a dissolução..
Curvas de saturação e solubilidade
As curvas de solubilidade são um banco de dados gráfico onde a quantidade de soluto que se dissolve em uma quantidade de solvente é comparada, a uma determinada temperatura.
As curvas de solubilidade são comumente traçadas para uma quantidade de soluto, sólido ou gasoso, em 100 gramas de água. As curvas de saturação para vários solutos na água são ilustradas na Figura 2..
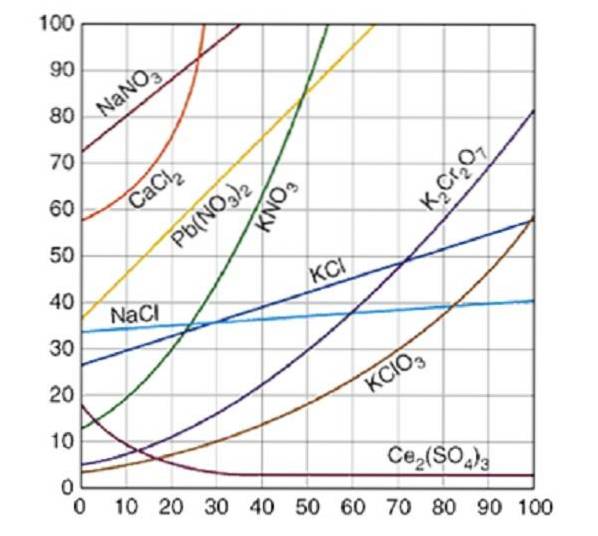
A curva indica o ponto de saturação em uma determinada temperatura. A área sob a curva indica que você tem uma solução insaturada e, portanto, mais soluto pode ser adicionado. Na área acima da curva há uma solução supersaturada.
Tomando o cloreto de sódio (NaCl) como exemplo, a 25 graus Celsius aproximadamente 35 gramas de NaCl podem ser dissolvidos em 100 gramas de água para obter uma solução saturada.
Exemplos de soluções diluídas
Soluções insaturadas podem ser encontradas diariamente, não é necessário estar em um laboratório químico.
O solvente não precisa ser necessariamente água. Abaixo estão alguns exemplos diários de soluções diluídas:
- Adicionar uma colher de sopa de açúcar a uma xícara de café quente produz uma solução de açúcar insaturada.
- O vinagre é uma solução diluída de ácido acético em água.
- O nevoeiro é uma solução insaturada (mas quase saturada) de vapor de água no ar.
- 0,01 M HCl é uma solução insaturada de ácido clorídrico em água.
- O álcool isopropílico é uma solução diluída de álcool isopropílico em água.
- A sopa é uma solução insaturada de água e cloreto de sódio.
- As bebidas alcoólicas são soluções diluídas de etanol e água. Normalmente, a porcentagem de álcool que eles têm é mostrada.
Referências
- Anne Marie Helmenstine, P. (2016, 7 de julho). Definição e exemplos de solução saturada. Recuperado de about.com.
- Cambrige University. (s.f.). Curvas de solubilidade. Recuperado de dynamicscience.com.au.
- Exemplos de solução saturada. (s.f.). Recuperado de example.yourdcitionary.com.
- J., S. (2014, 4 de junho). Soluções saturadas e supersaturadas. Recuperado de socratic.org.
- James, N. (s.f.). Solução saturada: definição e exemplos. Recuperado de study.com.
- M., B. (2014, 14 de outubro). Soluções saturadas e supersaturadas. Recuperado de socratic.org.
- Curvas de Solubilidade. (s.f.). Recuperado de kentchemistry.com.
- Pontas de saturação. (26 de junho de 2014). Recuperado de chem.libretexts.org.

Ainda sem comentários