
Propriedades periódicas dos elementos e suas características

As Propriedades periódicas dos elementos são aquelas que definem seu comportamento físico e químico do ponto de vista atômico, e cujas magnitudes, além do número atômico, permitem uma classificação dos átomos..
De todas as propriedades, estas caracterizam-se, como o próprio nome indica, por serem periódicas; ou seja, se a tabela periódica for estudada, será possível certificar que suas magnitudes obedecem a uma tendência que coincide e se repete com a ordenação dos elementos em períodos (linhas) e grupos (colunas).

Por exemplo, se um período é percorrido e uma propriedade periódica diminui em magnitude com cada elemento, o mesmo acontecerá com ela em todos os períodos. Por outro lado, se descer um grupo ou coluna aumenta sua magnitude, o mesmo pode acontecer para os outros grupos..
E assim, suas variações se repetem e mostram uma tendência simples que concorda com a ordenação dos elementos por seus números atômicos. Essas propriedades são diretamente responsáveis pelo caráter metálico ou não metálico dos elementos, bem como por suas reatividades, o que ajudou a classificá-los com maior profundidade..
Se por um momento a identidade dos elementos fosse desconhecida e eles fossem vistos como estranhas "esferas", a tabela periódica poderia ser reconstruída (com muito trabalho) fazendo uso dessas propriedades.
Desta forma, as supostas esferas adquiririam cores que permitiriam diferenciá-las em grupos (imagem superior). Conhecendo suas características eletrônicas, eles poderiam ser organizados em períodos, e os grupos revelariam aqueles que possuem o mesmo número de elétrons de valência..
Aprender e raciocinar sobre propriedades periódicas é o mesmo que saber por que os elementos reagem de uma forma ou de outra; é saber porque os elementos metálicos estão em certas regiões da mesa, e os elementos não metálicos em outras.
Índice do artigo
- 1 Quais são as propriedades periódicas e suas características
- 1.1 - Raio atômico
- 1.2 -Eletronegatividade
- 1.3 - Caráter metálico
- 1.4 - Energia de ionização
- 1.5 - Afinidade Eletrônica
- 2 referências
Quais são as propriedades periódicas e suas características
-Rádio atômico
Ao observar as esferas da imagem, a primeira coisa que se nota é que nem todas têm o mesmo tamanho. Alguns são mais volumosos do que outros. Se você olhar mais de perto, verá que esses tamanhos variam de acordo com um padrão: em um período ele diminui da esquerda para a direita e em um grupo aumenta de cima para baixo..
O acima também pode ser dito desta forma: o raio atômico diminui em direção aos grupos ou colunas à direita, e aumenta nos períodos ou linhas inferiores. Sendo assim, o raio atômico é a primeira propriedade periódica, pois suas variações seguem um padrão dentro dos elementos..
Carga nuclear vs elétrons
Por que esse padrão? Em um período os elétrons do átomo ocupam o mesmo nível de energia, que está relacionado à distância que os separa do núcleo. Quando passamos de um grupo para outro (que é o mesmo que passar pelo período à direita), o núcleo adiciona elétrons e prótons dentro do mesmo nível de energia..
Portanto, os elétrons não podem ocupar mais distâncias do núcleo, o que aumenta sua carga positiva por ter mais prótons. Conseqüentemente, os elétrons experimentam uma força de atração maior em direção ao núcleo, atraindo-os cada vez mais conforme o número de prótons aumenta..
É por isso que os elementos na extrema direita da tabela periódica (colunas amarelas e turquesa) têm os menores raios atômicos..
Por outro lado, quando você "salta" de um período para outro (o que é o mesmo que dizer que você desce um grupo), os novos níveis de energia habilitados permitem que os elétrons ocupem espaços mais distantes do núcleo. Estando mais longe, o núcleo (com mais prótons) os atrai com menos força; e os raios atômicos, portanto, aumentam.
Raios iônicos
Os raios iônicos seguem um padrão semelhante aos raios atômicos; No entanto, estes não dependem tanto do núcleo, mas de quantos ou menos elétrons o átomo tem em relação ao seu estado neutro..
Os cátions (Na+, ACdois+, Para o3+, Serdois+, Fé3+) exibem uma carga positiva porque perderam um ou mais elétrons e, portanto, o núcleo os atrai com maior força, pois há menos repulsões entre eles. O resultado: os cátions são menores do que os átomos dos quais são derivados.
E para os ânions (Odois-, F-, Sdois-, eu-) pelo contrário, exibem carga negativa porque têm um ou mais elétrons em excesso, aumentando suas repulsões entre si acima da atração exercida pelo núcleo. O resultado: os ânions são maiores do que os átomos dos quais são derivados (imagem abaixo).
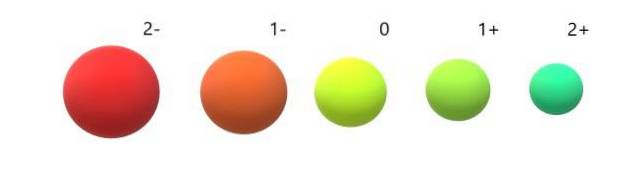
É apreciado que o ânion 2 é o mais volumoso de todos e o cátion 2+ o menor. Os raios aumentam quando o átomo está carregado negativamente e se contrai quando está carregado positivamente..
-Eletro-negatividade
Quando os elementos têm raios atômicos pequenos, não apenas seus elétrons são fortemente atraídos, mas também os elétrons de átomos vizinhos quando formam uma ligação química. Essa tendência de atrair elétrons de outros átomos dentro de um composto é conhecida como eletronegatividade..
Só porque um átomo é pequeno não significa que será mais eletronegativo. Nesse caso, os elementos hélio e hidrogênio seriam os átomos mais eletronegativos. O hélio, até onde a ciência mostrou, não forma uma ligação covalente de nenhum tipo; e hidrogênio, apenas tem um único próton no núcleo.
Quando os raios atômicos são grandes, os núcleos não têm força suficiente para atrair elétrons de outros átomos; portanto, os elementos mais eletronegativos são aqueles com um pequeno raio atômico e um maior número de prótons.
Novamente, aqueles que preenchem essas características perfeitamente são os elementos não metálicos do bloco p da tabela periódica; Estes são aqueles pertencentes ao grupo 16 ou oxigênio (O, S, Se, Te, Po) e grupo 17 ou flúor (F, Cl, Br, I, At).
Tendência
De acordo com tudo o que foi dito, os elementos mais eletronegativos estão localizados especialmente no canto superior direito da tabela periódica; tendo o flúor como elemento que encabeça a lista dos mais eletronegativos.
Por quê? Sem recorrer às escalas de eletronegatividade (Pauling, Mulliken, etc.), embora o flúor seja maior que o neon (o gás nobre de seu período), o primeiro pode formar ligações, enquanto o último não. Além disso, por seu tamanho pequeno, seu núcleo possui muitos prótons, e onde estiver o flúor, haverá um momento de dipolo.
-Caráter metálico
Se um elemento tem raio atômico em comparação com os de seu mesmo período, e também não é muito eletronegativo, então é um metal e tem um alto caráter metálico.
Se voltarmos à imagem principal, as esferas avermelhadas e esverdeadas, como as acinzentadas, correspondem a elementos metálicos. Os metais têm características únicas e, a partir daqui, as propriedades periódicas começam a se entrelaçar com as propriedades físicas e macroscópicas da matéria..
Elementos com alto caráter metálico são caracterizados por seus átomos relativamente grandes, fáceis de perder elétrons, uma vez que os núcleos dificilmente podem atraí-los para eles..
Como resultado, eles são facilmente oxidados ou perdem elétrons para formar cátions, M+; isso não significa que todos os cátions são metálicos.
Tendência
Neste ponto, você pode prever como o caráter metálico varia na tabela periódica. Se é sabido que os metais têm grandes raios metálicos e também são poucos eletronegativos, deve-se esperar que os elementos mais pesados (os períodos inferiores) sejam os mais metálicos; e os elementos mais leves (os períodos superiores), os menos metálicos.
Além disso, o caráter metálico diminui quanto mais eletronegativo o elemento se torna. Isso significa que percorrendo os períodos e grupos à direita da tabela periódica, em seus períodos superiores, eles encontrarão os elementos menos metálicos..
Portanto, o caráter metálico aumenta descendo por um grupo e diminui da esquerda para a direita no mesmo período. Entre os elementos metálicos temos: Na (sódio), Li (lítio), Mg (magnésio), Ba (bário), Ag (prata), Au (ouro), Po (polônio), Pb (chumbo), Cd (cádmio ), Al (alumínio), etc.
-Energia de ionização
Se um átomo tem um raio atômico grande, é de se esperar que seu núcleo não retenha elétrons nas camadas mais externas presas com força considerável. Conseqüentemente, removê-los do átomo na fase gasosa (individualizado) não exigirá muita energia; ou seja, a energia de ionização, EI, necessária para remover um elétron deles.
EI também equivale a dizer que é a energia que deve ser fornecida para superar a força atrativa do núcleo de um átomo ou íon gasoso em seu elétron mais externo. Quanto menor o átomo e mais eletronegativo, menor será o seu EI; esta é a sua tendência.
A seguinte equação ilustra um exemplo:
Na (g) => Na+(g) + e-
O EI necessário para conseguir isso não é tão grande em comparação com a segunda ionização:
N / D+(g) => Nadois+(g) + e-
Já que em Na+ as cargas positivas predominam e o íon é menor que o átomo neutro. Consequentemente, o núcleo do Na+ atrai elétrons com uma força muito maior, exigindo um EI muito maior.
-Afinidade eletrônica
E, finalmente, há a propriedade periódica da afinidade eletrônica. Esta é a tendência energética do átomo de um elemento na fase gasosa de aceitar um elétron. Se o átomo for pequeno e tiver um núcleo com grande força atrativa, será fácil para ele aceitar o elétron, formando um ânion estável..
Quanto mais estável for o ânion em relação ao átomo neutro, maior será sua afinidade eletrônica. No entanto, as repulsões entre os próprios elétrons também entram em jogo.
O nitrogênio, por exemplo, tem uma afinidade eletrônica maior do que o oxigênio. Isso ocorre porque seus três elétrons 2p estão desemparelhados e se repelem menos o elétron que entra; enquanto no oxigênio, há um par de elétrons emparelhados que exercem maior repulsão eletrônica; e no flúor, existem dois pares.
É por esta razão que se diz que a tendência das afinidades eletrônicas se normalizou a partir do terceiro período da tabela periódica..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Prof. Ortega Graciela M. (1 de abril de 2014). Propriedades periódicas dos elementos. Color abc. Recuperado de: abc.com.py
- Chemistry LibreTexts. (7 de junho de 2017). Propriedades periódicas dos elementos. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (2 de janeiro de 2019). As propriedades periódicas dos elementos. Recuperado de: Thoughtco.com
- Toppr. (s.f.). Propriedades periódicas dos elementos. Recuperado de: toppr.com /
- Propriedades periódicas dos elementos: uma jornada pela mesa é uma jornada pela química. [PDF]. Recuperado de: cod.edu


Ainda sem comentários