
Fórmulas, propriedades, usos e riscos do nitrato de alumínio
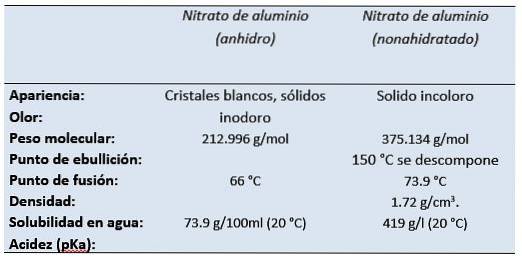
O nitrato de alumínio É o sal de alumínio do ácido nítrico. O nitrato de alumínio não hidratado, à temperatura ambiente, apresenta-se como um sólido incolor com odor de ácido nítrico..
Eles não são combustíveis, mas podem acelerar a combustão de materiais combustíveis. Se grandes quantidades de nitrato de alumínio estiverem envolvidas, ou se o material combustível for finamente dividido, pode ocorrer uma explosão..

A exposição prolongada ao fogo ou calor pode causar uma explosão. Quando entram em contato com o fogo, produzem óxidos de nitrogênio. Seus usos incluem o refino de petróleo e o tingimento e curtimento de couro..
É um sal branco solúvel em água que ocorre mais comumente em sua forma cristalina nona-hidratada (nitrato de alumínio não-hidratado)..
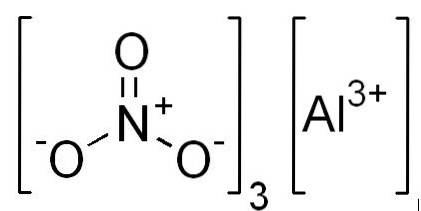
Índice do artigo
- 1 Fórmulas
- 2 Estrutura
- 2.1 Em 2D
- 2.2 Em 3D
- 3 Propriedades físicas e químicas
- 3.1 Alertas de reatividade
- 3.2 Reações com ar e água
- 3.3 Inflamabilidade
- 3.4 Reatividade
- 3,5 Toxicidade
- 4 usos
- 5 efeitos clínicos
- 6 Segurança e riscos
- 6.1 Classes de perigo GHS
- 6.2 Códigos de declaração de precaução
- 7 referências
Fórmulas
- Nitrato de alumínio: Al (NO3)3
- Nitrato de alumínio não hidratado: Al (NO3)3 9hdoisOU
- CAS: 13473-90-0 Nitrato de alumínio (anidro)
- CAS: 14797-65-0 Nitrato de alumínio (não hidratado)
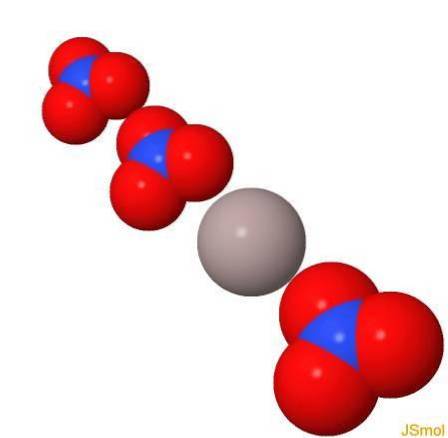
Estrutura
Em 2D
Em 3d
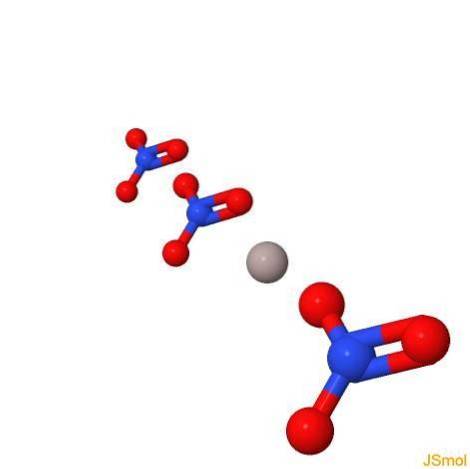
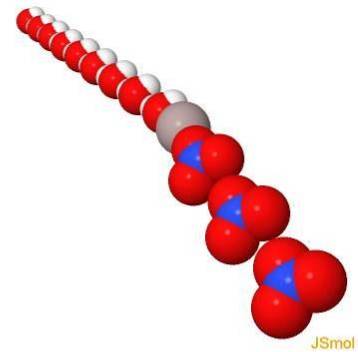
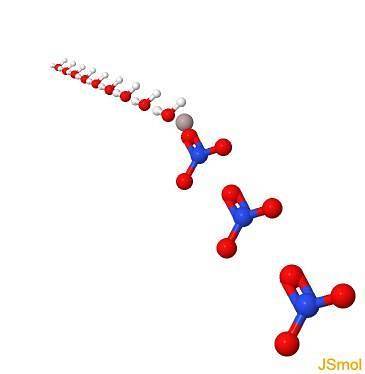
Propriedades físicas e químicas
- O nitrato de alumínio pertence ao grupo reativo de nitrato inorgânico e compostos de nitrito.
- O íon nitrato é um íon poliatômico com a fórmula molecular NO3 - e é a base conjugada do ácido nítrico.
- Quase todos os sais de nitrato inorgânico são solúveis em água à temperatura e pressão padrão..
- Os compostos de nitrato têm uma ampla gama de usos com base em sua atividade como agentes oxidantes, na presença de nitrogênio disponível gratuitamente ou em sua alta solubilidade..
Alertas de reatividade
O nitrato de alumínio é um forte agente oxidante.
Reações com ar e água
O nitrato de alumínio é deliquescente (tem a propriedade de absorver a umidade do ar para formar uma solução aquosa). É solúvel em água. Suas soluções aquosas são ácidas.
Inflamabilidade
Nitratos e nitritos são compostos explosivos. Algumas dessas substâncias podem se decompor de forma explosiva quando aquecidas ou envolvidas em um incêndio. Eles podem explodir com o calor ou contaminação. Os recipientes podem explodir quando aquecidos.
Perigos especiais de produtos de combustão: óxidos de nitrogênio tóxicos podem se formar em um incêndio envolvendo nitrato de alumínio.
Reatividade
Os nitratos e nitritos podem atuar como agentes oxidantes extremamente poderosos e as misturas com agentes redutores ou materiais reduzidos, como substâncias orgânicas, podem ser explosivas. Reage com ácidos para formar dióxido de nitrogênio tóxico.
Em geral, os sais de nitrato e nitrito com cátions redox ativos (metais de transição e os metais do grupo 3a, 4a e 5a da tabela periódica, bem como o cátion amônio [NH4] +) são mais reativos com materiais orgânicos e agentes. em condições ambientais.
O nitrato de alumínio é um agente oxidante. As misturas com ésteres alquílicos podem explodir. Misturas com fósforo, cloreto de estanho (II) ou outros agentes redutores podem reagir de forma explosiva.
Toxicidade
Os humanos estão sujeitos à toxicidade por nitrato e nitrito, sendo as crianças especialmente vulneráveis à metemoglobinemia.
A ingestão de grandes doses de nitrato de alumínio causa irritação gástrica, náuseas, vômitos e diarreia. O contato com a poeira irrita os olhos e a pele.
Formulários
Nitratos e nitritos são amplamente utilizados (e em quantidades muito grandes) como fertilizantes na agricultura devido à sua disposição em quebrar e liberar nitrogênio para o crescimento das plantas e devido à sua solubilidade, que permite que os íons nitrato sejam absorvidos pelas raízes da planta.
Os compostos de nitrato também são amplamente usados como matéria-prima industrial quando um agente oxidante ou fonte de íon nitrato é necessária..
O nitrato de alumínio é usado na fabricação de produtos químicos de laboratório, cosméticos e higiene pessoal. Na indústria, é utilizado como intermediário na fabricação de outras substâncias.
É utilizado no curtimento de couro, em antitranspirantes, inibidores de corrosão, na extração de urânio, no refino de petróleo e como agente nitretante..
O nitrato de alumínio não-hidratado e outros nitratos de alumínio hidratado têm muitas aplicações. Esses sais são usados na produção de alumina para a preparação de papéis isolantes, em elementos de aquecimento de tubos de raios catódicos e nos laminados de núcleos de transformadores. Os sais hidratados também são usados para a extração de elementos actinídicos.
Efeitos clínicos
O alumínio é onipresente, é o metal mais abundante na crosta terrestre. A maior parte da exposição humana vem dos alimentos. Está presente em alguns produtos farmacêuticos. Na indústria é amplamente utilizado.
O alumínio inibe a remodelação óssea, causando osteomalácia. Acredita-se que inibe a eritropoiese, causando anemia.
O envenenamento agudo é raro. As formas solúveis de alumínio apresentam maior potencial de toxicidade do que as formas insolúveis, devido à sua maior absorção..
Pacientes com insuficiência renal são propensos à toxicidade do alumínio, seja do alumínio no dialisado ou de outras fontes exógenas, especialmente aglutinantes de fosfato e antiácidos contendo alumínio..
A exposição crônica ao pó de alumínio pode causar dispneia, tosse, fibrose pulmonar, pneumotórax, pneumoconiose, encefalopatia, fraqueza, incoordenação e convulsões epileptiformes..
Os sais de alumínio podem causar irritação nos olhos e nas membranas mucosas, conjuntivite, dermatose e eczema..
Embora o alumínio e seus compostos tenham mostrado poucas evidências de carcinogenicidade em humanos, a exposição a outras substâncias envolvidas na produção de alumínio foi associada à carcinogenicidade..
Segurança e riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS).
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema internacionalmente aceito, criado pelas Nações Unidas e projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes globalmente..
As classes de perigo (e seu capítulo correspondente do GHS), as normas de classificação e rotulagem e as recomendações para nitrato de alumínio e nitrato de alumínio nona-hidratado são as seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Classes de perigo GHS
H272: Pode agravar incêndios; Oxidante [Aviso Líquidos oxidantes; Sólidos oxidantes - categoria 3] (PubChem, 2017).
H301: Tóxico por ingestão [Acute Toxicity Hazard, Oral - Category 3] (PubChem, 2017).
H315: Causa irritação na pele [Advertência, corrosão / irritação na pele - Categoria 2] (PubChem, 2017).
H318: Causa lesões oculares graves [Perigo Lesões oculares graves / irritação ocular - Categoria 1] (PubChem, 2017).
H319: Causa irritação ocular grave [Advertência Lesões oculares graves / irritação ocular - Categoria 2A] (PubChem, 2017).
Códigos de declaração de precaução
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P501, e P501 (PubChem, 2017).





Referências
- ChemIDplus (2017) Estrutura 3D de 13473-90-0 - Nitrato de alumínio [imagem] Recuperado de: chem.nlm.nih.gov.
- ChemIDplus (2017) Estrutura 3D de 7784-27-2 - Nitrato de alumínio nonahidratado [imagem] Recuperado de: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [imagem] Recuperado de: flickr.com.
- Edgar181 (2008) Nitrato de alumínio [imagem]. Recuperado de: wikipedia.org.
- Agência Europeia dos Produtos Químicos (ECHA). (2016). Nitrato de alumínio. Breve Perfil. Retirado em 8 de fevereiro de 2017, de echa.europa.eu.
- Banco de dados de substâncias perigosas (HSDB). TOXNET. (2017). Nitrato de alumínio. Bethesda, MD, EU: National Library of Medicine. Recuperado de: chem.nlm.nih.gov.
- JSmol (2017) Nitrato [imagem] Recuperado de: chemapps.stolaf.edu.
- Wikipedia. (2017). Nitrato de alumínio. Recuperado em 8 de fevereiro de 2017, em: wikipedia.org.
- Wikipedia. (2017). Nitrato de alumínio não hidratado. Recuperado em 8 de fevereiro de 2017, em: wikipedia.org.



Ainda sem comentários