
Estrutura das moléculas anfipáticas, características, exemplos
As moléculas anfipáticas ou anfifílicas São aqueles que podem sentir afinidade ou repulsão ao mesmo tempo por um determinado solvente. Os solventes são quimicamente classificados como polares ou apolares; hidrofílico ou hidrofóbico. Assim, esses tipos de moléculas podem "amar" a água, assim como também podem "odiá-la"..
De acordo com a definição anterior, só existe uma maneira para que isso seja possível: essas moléculas devem ter regiões polares e apolares em suas estruturas; Ou eles são mais ou menos homogeneamente distribuídos (como é o caso das proteínas, por exemplo), ou são heterogeneamente localizados (no caso dos surfactantes)

Os surfactantes, também chamados de detergentes, são talvez as moléculas anfipáticas mais conhecidas de todos, desde tempos imemoriais. Desde que o Homem foi cativado pela estranha fisionomia de uma bolha, preocupado com o preparo de sabonetes e produtos de limpeza, ele se deparou repetidas vezes com o fenômeno da tensão superficial..
Observar uma bolha é o mesmo que presenciar uma “armadilha” cujas paredes, formadas pelo alinhamento de moléculas anfipáticas, retêm o conteúdo gasoso do ar. Suas formas esféricas são as mais matematicamente e geometricamente estáveis, pois reduzem ao mínimo a tensão superficial da interface ar-água..
Dito isso, duas outras características das moléculas anfipáticas foram discutidas: elas tendem a se associar ou se automontar, e algumas tensões superficiais mais baixas em líquidos (aquelas que podem fazer isso são chamadas de surfactantes).
Como resultado da alta tendência de associação, essas moléculas abrem um campo de estudo morfológico (e até arquitetônico) de seus nanoagregados e das supramoléculas que os compõem; com o objetivo de projetar compostos que possam ser funcionalizados e interagir de formas incomensuráveis com as células e suas matrizes bioquímicas..
Índice do artigo
- 1 Estrutura
- 1.1 Interações intermoleculares
- 1.2 Diversos
- 2 Características das moléculas anfipáticas
- 2.1 Associação
- 2.2 Físico
- 3 exemplos
- 4 aplicativos
- 4.1 Membranas celulares
- 4.2 Dispersantes
- 4.3 Emulsificantes
- 4.4 Detergentes
- 4.5 Antioxidantes
- 5 referências
Estrutura
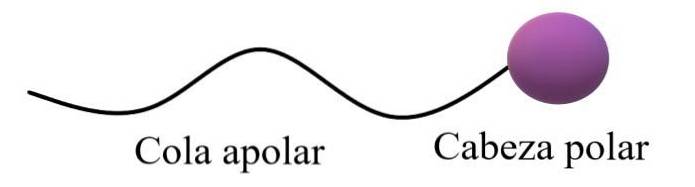
Moléculas anfifílicas ou anfipáticas teriam uma região polar e uma região apolar. A região apolar geralmente consiste em uma cadeia de carbono saturada ou insaturada (com ligações duplas ou triplas), que é representada como uma "cauda apolar"; acompanhada por uma "cabeça polar", na qual residem os átomos mais eletronegativos.
A estrutura geral superior ilustra os comentários do parágrafo anterior. A cabeça polar (esfera roxa) pode ser grupos funcionais ou anéis aromáticos que têm momentos de dipolo permanentes e também são capazes de formar ligações de hidrogênio. Portanto, o maior conteúdo de oxigênio e nitrogênio deve estar localizado lá.
Nesta cabeça polar também podem haver cargas iônicas, negativas ou positivas (ou ambas ao mesmo tempo). Esta região é a que apresenta grande afinidade por água e outros solventes polares..
Por outro lado, a cauda apolar, devido às suas ligações C-H predominantes, interage por meio das forças de dispersão de Londres. Essa região é responsável pelo fato de as moléculas anfipáticas também apresentarem afinidade por gorduras e moléculas apolares no ar (Ndois, COdois, Ar, etc.).
Em alguns textos de química, o modelo da estrutura superior é comparado ao formato de um pirulito.
Interações intermoleculares
Quando uma molécula anfipática entra em contato com um solvente polar, digamos a água, suas regiões exercem efeitos diferentes nas moléculas do solvente..
Para começar, as moléculas de água buscam solvatar ou hidratar a cabeça polar, ficando longe da cauda apolar. Neste processo, a desordem molecular é criada.
Enquanto isso, as moléculas de água ao redor da cauda apolar tendem a se organizar como se fossem pequenos cristais, permitindo-lhes minimizar as repulsões. Neste processo, uma ordem molecular é criada.
Entre distúrbios e ordens, chegará um ponto em que a molécula anfipática buscará interagir com outra, o que resultará em um processo muito mais estável.
Miscelas
Ambos serão abordados através de suas caudas apolares ou cabeças polares, de forma que as regiões relacionadas interajam primeiro. Isso é o mesmo que imaginar que dois "pirulitos roxos" na imagem acima, se aproximam entrelaçando suas caudas pretas, ou juntando suas duas cabeças roxas..
E assim começa um interessante fenômeno de associação, no qual várias dessas moléculas são unidas consecutivamente. Eles não são associados arbitrariamente, mas de acordo com uma série de parâmetros estruturais, que acabam isolando as caudas apolares em uma espécie de “núcleo apolar”, ao mesmo tempo em que expõe as cabeças polares como uma casca polar..
Diz-se então que nasceu uma miscela esférica. No entanto, durante a formação da miscela ocorre uma etapa preliminar que consiste no que é conhecido como bicamada lipídica. Estas e outras são algumas das muitas macroestruturas que as moléculas anfifílicas podem adotar.
Características das moléculas anfipáticas
Associação

Se as caudas apolares forem tomadas como unidades pretas e as cabeças polares como unidades roxas, será entendido porque na imagem superior a casca da miscela é roxa e seu núcleo é preto. O núcleo é apolar e suas interações com as moléculas de água ou solvente são zero..
Se, por outro lado, o solvente ou meio é apolar, são as cabeças polares que sofrerão as repulsões e, conseqüentemente, estarão localizadas no centro da miscela; ou seja, está invertido (A, imagem inferior).
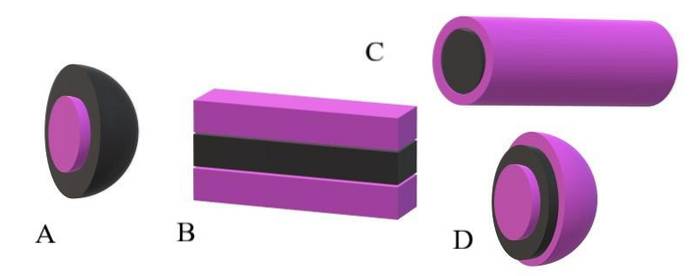
Observa-se que a miscela invertida possui uma concha apolar preta e um núcleo polar roxo. Mas, antes que as miscelas se formem, as moléculas anfifílicas são encontradas alterando individualmente a ordem das moléculas do solvente. Aumento da concentração, eles começam a se associar em uma estrutura de uma ou duas camadas (B).
A partir de B, as lâminas começam a se curvar para formar D, uma vesícula. Outra possibilidade, dependendo do formato da cauda apolar em relação à sua cabeça polar, é que eles se associam para dar origem a uma miscela cilíndrica (C)..
Nanoagregados e supramoléculas
Existem, portanto, cinco estruturas principais, que revelam uma característica fundamental dessas moléculas: sua alta tendência a se associar e se automontar em supramoléculas, que se agregam para formar nanoagregados..
Assim, as moléculas anfifílicas não são encontradas sozinhas, mas em associação..
Fisica
As moléculas anfipáticas podem ser neutras ou ionicamente carregadas. Aqueles que têm cargas negativas têm um átomo de oxigênio com carga formal negativa em sua cabeça polar. Alguns desses átomos de oxigênio vêm de grupos funcionais, como: -COO-, -SW4-, -SW3- ou -PO4-.
Em relação às cargas positivas, geralmente vêm de aminas, RNH3+.
A presença ou ausência dessas cargas não muda o fato de que essas moléculas geralmente formam sólidos cristalinos; ou, se forem relativamente leves, são encontrados como óleos.
Exemplos
Alguns exemplos de moléculas anfipáticas ou anfifílicas serão mencionados abaixo:
-Fofolipídios: fosfatidiletanolamina, esfingomielina, fosfatidilserina, fosfatidilcolina.
-Colesterol.
-Glicolipidos.
-Lauril sulfato de sódio.
-Proteínas (são anfifílicas, mas não surfactantes).
-Gorduras fenólicas: cardanol, cardóis e ácidos anacárdicos.
-Brometo de cetiltrimetilamónio.
-Ácidos graxos: palmítico, linoléico, oleico, láurico, esteárico.
-Álcoois de cadeia longa: 1-dodecanol e outros.
-Polímeros anfifílicos: como resinas fenólicas etoxiladas.
Formulários
Membranas celulares
Uma das consequências mais importantes da capacidade de associação dessas moléculas é que elas constroem uma espécie de parede: a bicamada lipídica (B).
Esta bicamada se estende para proteger e regular a entrada e saída de compostos nas células. É dinâmico, pois suas caudas apolares giram ajudando as moléculas anfipáticas a se moverem..
Da mesma forma, quando esta membrana é fixada em duas extremidades, para ser verticalmente, é utilizada para medir sua permeabilidade; e com isso, dados valiosos são obtidos para o projeto de materiais biológicos e membranas sintéticas a partir da síntese de novas moléculas anfipáticas com diferentes parâmetros estruturais..
Dispersantes
Na indústria do petróleo, essas moléculas e os polímeros sintetizados a partir delas são usados para dispersar asfaltenos. O foco desta aplicação repousa na hipótese de que os asfaltenos consistem em um sólido coloidal, com alta tendência a flocular e sedimentar como um sólido marrom-preto que causa sérios problemas econômicos..
As moléculas anfipáticas ajudam a manter os asfaltenos dispersos por mais tempo em face das mudanças físico-químicas do petróleo..
Emulsificantes
Essas moléculas ajudam a misturar dois líquidos que não seriam miscíveis em condições normais. Nos sorvetes, por exemplo, ajudam a água e o ar a formar parte do mesmo sólido junto com a gordura. Entre os emulsificantes mais utilizados para esse fim estão os derivados de ácidos graxos comestíveis..
Detergentes
O caráter anfifílico dessas moléculas é usado para reter gorduras ou impurezas apolares, para depois serem transportadas ao mesmo tempo por um solvente polar, como a água..
Como o exemplo das bolhas em que o ar ficou preso, os detergentes prendem a gordura dentro de suas micelas, que, tendo uma casca polar, interagem de forma eficiente com a água para remover a sujeira..
Antioxidantes
As cabeças polares são de vital importância, pois definem os múltiplos usos que essas moléculas podem ter dentro do corpo.
Se eles tiverem, por exemplo, um conjunto de anéis aromáticos (incluindo derivados de um anel fenólico) e anéis polares capazes de neutralizar os radicais livres, então haverá antioxidantes anfifílicos; e se eles também não tiverem efeitos tóxicos, então haverá novos antioxidantes disponíveis no mercado.
Referências
- Alberts B, Johnson A, Lewis J, et al. (2002). Biologia molecular da célula. 4ª edição. Nova York: Garland Science; The Lipid Bilayer. Recuperado de: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Moléculas anfifílicas. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (eds.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Disse Joseph. (2019). Definição de moléculas anfipáticas. Estudar. Recuperado de: study.com
- Lehninger, A. L. (1975). Bioquímica. (2ª Edição). Worth Publishers, Inc..
- Mathews, C. K., van Holde, K. E. e Ahern, K. G. (2002). Bioquímica. (3ª Edição). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31 de março de 2019). O que é um surfactante? Recuperado de: Thoughtco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù e Pietro Calandra (2015). Auto-montagem de anfifílicos: conceitos básicos e perspectivas futuras das abordagens supramoleculares. Advances in Condensed Matter Physics, vol. 2015, Artigo ID 151683, 22 páginas, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). Um novo grupo de moléculas anfifílicas contendo fenólicos sintéticos para aplicações polivalentes: caracterização físico-química e estudo de toxicidade celular. Scientific Reportsvolume 8, Article number: 832.



Ainda sem comentários