
Fórmulas e unidades de Charles Law, experimentos, exercícios
O Charles Law ou Guy-Lussac é aquele que permite afirmar uma das propriedades do estado gasoso: o volume que um gás ocupa é diretamente proporcional à temperatura a pressão constante.
Essa proporcionalidade é linear para todas as faixas de temperatura se o gás em questão for ideal; gases reais, por outro lado, desviam-se da tendência linear em temperaturas próximas de seu ponto de orvalho. No entanto, isso não limitou o uso desta lei para uma miríade de aplicações envolvendo gases..

Uma das aplicações quintessenciais da lei de Charles é em balões de ar. Outros balões mais simples, como os dos desejos, também chamados de lanternas chinesas (imagem superior), revelam a relação entre o volume e a temperatura de um gás em pressão constante.
Por que sob pressão constante? Porque se a pressão aumentasse, significaria que o recipiente onde se encontra o gás está hermeticamente fechado; e com isso, as colisões ou impactos das partículas gasosas contra as paredes internas do referido recipiente aumentariam (lei de Boyle-Mariotte).
Portanto, não haveria alteração no volume ocupado pelo gás, e a lei de Charles estaria faltando. Ao contrário de um recipiente hermético, o tecido dos balões de desejos representa uma barreira móvel, capaz de se expandir ou contrair dependendo da pressão exercida pelo gás em seu interior..
No entanto, conforme o tecido dos balões se expande, a pressão interna do gás permanece constante porque a área sobre a qual suas partículas colidem aumenta. Quanto maior for a temperatura do gás, maior será a energia cinética das partículas e, portanto, o número de colisões.
E conforme o balão se expande novamente, as colisões contra suas paredes internas permanecem (idealmente) constantes..
Portanto, quanto mais quente o gás, maior será a expansão do balão e mais alto ele aumentará. O resultado: luzes avermelhadas (embora perigosas) suspensas no céu nas noites de dezembro..
Índice do artigo
- 1 O que é a lei de Charles?
- 1.1 Declaração
- 1.2 Empregos
- 1.3 Gráfico
- 2 Fórmulas e unidades de medida
- 2.1 Fórmulas
- 2.2 Unidades
- 3 Experimente para provar a lei
- 3.1 Montagem
- 3.2 Desenvolvimento
- 3.3 Balão com gelo no inverno
- 4 exercícios resolvidos
- 4.1 Exercício 1
- 4.2 Exercício 2
- 4.3 Exercício 3
- 5 aplicativos
- 5.1 Balões de desejos
- 5.2 Termômetros pop-up ou turquia
- 5.3 Restaurando a forma das bolas de pingue-pongue
- 5.4 Preparação dos pães
- 6 referências
Qual é a lei de Charles?
Demonstração
A chamada Lei de Charles ou Lei de Gay-Lussac explica a dependência que existe entre o volume ocupado por um gás e o valor de sua temperatura absoluta ou temperatura Kelvin..
A Lei pode ser enunciada da seguinte forma: se a pressão permanece constante, segue-se que “para uma dada massa de um gás, ela aumenta seu volume em aproximadamente 1/273 vezes seu volume a 0 ºC, para cada grau centígrado (1 ºC) para aumentar sua temperatura ".
Empregos
O trabalho de pesquisa que estabeleceu a lei foi iniciado na década de 1780 por Jacques Alexander Cesar Charles (1746-1823). No entanto, Charles não publicou os resultados de sua pesquisa..
Posteriormente, John Dalton em 1801 conseguiu determinar experimentalmente que todos os gases e vapores, por ele estudados, se expandem entre duas temperaturas determinadas na mesma quantidade de volume. Esses resultados foram confirmados por Gay-Lussac no ano de 1802.
Os trabalhos de pesquisa de Charles, Dalton e Gay-Lussac, permitiram estabelecer que o volume ocupado por um gás e sua temperatura absoluta são diretamente proporcionais. Portanto, há uma relação linear entre a temperatura e o volume de um gás.
Gráfico
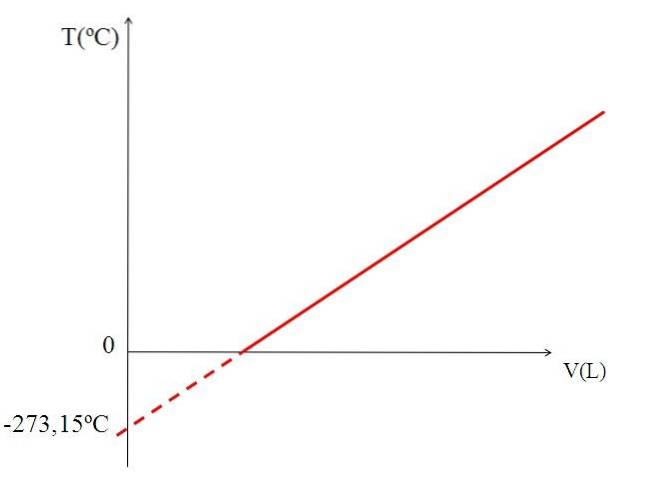
A representação gráfica (imagem superior) do volume de um gás em relação à temperatura produz uma linha reta. A intersecção da linha com o eixo X, a uma temperatura de 0 ºC, permite a obtenção do volume do gás a 0 ºC.
Da mesma forma, a intersecção da linha com o eixo X daria informações sobre a temperatura para a qual o volume ocupado pelo gás seria zero "0". Dalton estimou este valor em -266 ºC, próximo ao valor sugerido por Kelvin para zero absoluto (0).
Kelvin propôs uma escala de temperatura cujo zero deveria ser a temperatura na qual um gás perfeito teria um volume zero. Mas a essas baixas temperaturas, os gases são liquefeitos.
Por isso não é possível falar de volumes de gases propriamente ditos, achando que o valor do zero absoluto deveria ser -273,15 ºC.
Fórmulas e unidades de medida
Fórmulas
A lei de Charles em sua versão moderna afirma que o volume e a temperatura de um gás são diretamente proporcionais.
Então:
V / T = k
V = volume de gás. T = temperatura Kelvin (K). k = constante de proporcionalidade.
Para um volume V1 e uma temperatura T1
k = V1 / T1
Da mesma forma, para um volume Vdois e uma temperatura Tdois
k = Vdois / Tdois
Então, igualando as duas equações para k, temos
V1 / T1 = Vdois / Tdois
Esta fórmula pode ser escrita da seguinte forma:
V1 Tdois = Vdois T1
Resolvendo para Vdois, você obtém a fórmula:
Vdois = V1 Tdois / T1
Unidades
O volume do gás pode ser expresso em litros ou em qualquer uma de suas unidades derivadas. Da mesma forma, o volume pode ser expresso em metros cúbicos ou em qualquer unidade derivada. A temperatura deve ser expressa em temperatura absoluta ou temperatura Kelvin.
Assim, se as temperaturas de um gás são expressas em graus centígrados ou na escala Celsius, para realizar um cálculo com elas, seria necessário somar às temperaturas 273,15 ºC, para trazê-las a temperaturas absolutas ou kelvin..
Se as temperaturas forem expressas em graus Fahrenheit, seria necessário adicionar 459,67 ºR a essas temperaturas, para trazê-las a temperaturas absolutas na escala Rankine..
Outra fórmula bem conhecida da Lei de Carlos, e diretamente relacionada à sua declaração, é a seguinte:
Vt = Vou (1 + t / 273)
Onde Vt é o volume ocupado por um gás a uma determinada temperatura, expresso em litros, cm3, etc .; e Vou é o volume ocupado por um gás a 0 ºC. Por sua vez, t é a temperatura na qual o volume é medido, expressa em graus centígrados (ºC).
E, finalmente, 273 representa o valor do zero absoluto na escala de temperatura Kelvin.
Experimente provar a lei
Montagem
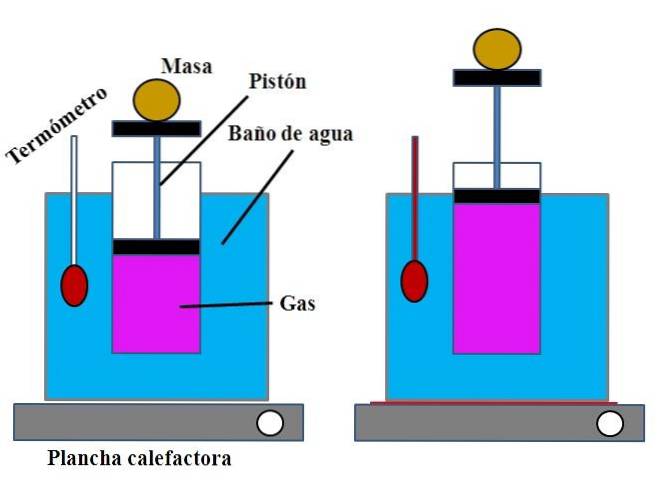
Em um recipiente com água, que cumpria a função de banho-maria, era colocado um cilindro aberto na parte superior, com um êmbolo que se encaixava na parede interna do cilindro (imagem superior).
Este êmbolo (composto pelo pistão e as duas bases pretas) pode mover-se para a parte superior ou inferior do cilindro, dependendo do volume de gás que contém..
O banho-maria poderia ser aquecido por meio de um queimador ou planta de aquecimento, que fornecia o calor necessário para aumentar a temperatura do banho e, portanto, a temperatura do cilindro equipado com êmbolo..
Uma determinada massa foi colocada no êmbolo para garantir que o experimento fosse realizado com pressão constante. A temperatura do banho e do cilindro foi medida por meio de um termômetro colocado no banho-maria..
Embora o cilindro provavelmente não tivesse uma graduação para visualizar o volume de ar, este poderia ser estimado medindo-se a altura atingida pela massa colocada no pistão e a superfície da base do cilindro..
Em desenvolvimento
O volume de um cilindro é obtido multiplicando-se a área da superfície de sua base por sua altura. A superfície da base do cilindro pode ser obtida aplicando a fórmula: S = Pi x rdois.
Enquanto a altura é obtida medindo a distância da base do cilindro, até a parte do pistão sobre a qual a massa repousa.
Conforme a temperatura do banho foi aumentada pelo calor produzido pelo isqueiro, observou-se que o êmbolo subia dentro do cilindro. Em seguida, eles leram no termômetro a temperatura no banho-maria, que correspondia à temperatura dentro do cilindro..
Da mesma forma, mediram a altura da massa acima do êmbolo, podendo estimar o volume de ar que correspondia à temperatura medida. Dessa forma, eles fizeram várias medições da temperatura e estimativas do volume de ar correspondente a cada uma das temperaturas..
Com isso, finalmente foi possível estabelecer que o volume que um gás ocupa é diretamente proporcional à sua temperatura. Esta conclusão permitiu enunciar a chamada Lei de Carlos.
Balão com gelo no inverno
Além do experimento anterior, existe um mais simples e qualitativo: o do balão com gelo no inverno..
Se um balão cheio de hélio fosse colocado em uma sala aquecida no inverno, o balão teria um certo volume; Mas, se posteriormente fosse transferido para o exterior da casa com uma temperatura baixa, seria observado que o balão de hélio encolhe, reduzindo seu volume de acordo com a Lei de Carlos..
Exercícios resolvidos
Exercício 1
Existe um gás que ocupa um volume de 750 cm3 a 25 ºC: qual será o volume que este gás ocupará a 37 ºC se a pressão for mantida constante?
É necessário primeiro transformar as unidades de temperatura em Kelvin:
T1 em graus Kelvin = 25 ºC + 273,15 ºC = 298,15 K
Tdois em graus Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Porque V1 e as outras variáveis, resolvemos para Vdois e é calculado com a seguinte equação:
Vdois = V1 · (Tdois / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Exercício 2
Qual seria a temperatura em graus Celsius à qual teriam que ser aquecidos 3 litros de um gás a 32 ºC, para que seu volume se expandisse para 3,2 litros?
Novamente, os graus centígrados são transformados em Kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
E como no exercício anterior, T é limpodois em vez de Vdois, e é calculado abaixo:
Tdois = Vdois · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Mas a declaração pede graus centígrados, então a unidade de T é alteradadois:
Tdois em graus centígrados = 325, 49 º C (K) - 273,15 ºC (K)
= 52,34 ºC
Exercício 3
Se um gás a 0 ºC ocupa um volume de 50 cm3, Que volume vai ocupar a 45 ºC?
Usando a fórmula original da lei de Charles:
Vt = Vou (1 + t / 273)
Prosseguimos para calcular Vt diretamente, pois todas as variáveis estão disponíveis:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Por outro lado, se o problema for resolvido usando a estratégia dos exemplos 1 e 2, teremos:
Vdois = V1 · (Tdois / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
O resultado, aplicando os dois procedimentos, é o mesmo porque, em última análise, eles se baseiam no mesmo princípio da lei de Charles.
Formulários
Desejo balões
Os balões de desejo (já mencionados na introdução) são equipados com um material têxtil impregnado com um líquido combustível.
Quando esse material é incendiado, ocorre um aumento na temperatura do ar contido no balão, o que provoca um aumento no volume do gás de acordo com a lei de Charles..
Portanto, ao aumentar o volume de ar no balão, a densidade do ar nele diminui, tornando-se menor que a densidade do ar circundante, e é por isso que o balão sobe.
Termômetros pop-up ou turquia
Como seu nome indica, eles são usados durante o cozimento de perus. O termômetro possui um recipiente cheio de ar fechado com uma tampa e é calibrado de forma que quando a temperatura ideal de cozimento é atingida, a tampa é levantada emitindo um som..
O termômetro é colocado dentro do peru e, conforme a temperatura dentro do forno aumenta, o ar dentro do termômetro se expande, aumentando seu volume. Então, quando o volume do ar atingir um determinado valor, levante a tampa do termômetro.
Restaurando a forma de bolas de pingue-pongue
Dependendo dos requisitos de uso, as bolas de pingue-pongue são leves e suas paredes de plástico são finas. Isso faz com que ao serem impactados pelas raquetes sofram deformações.
Ao colocar as bolas deformadas em água quente, o ar interno se aquece e se expande, levando a um aumento do volume de ar. Isso também faz com que a parede das bolas de pingue-pongue se estique, permitindo que voltem à sua forma original..
Fazendo pão
As leveduras são incorporadas à farinha de trigo usada para fazer pão e têm a capacidade de produzir gás dióxido de carbono..
À medida que a temperatura dos pães aumenta durante o cozimento, o volume de dióxido de carbono aumenta. É por isso que o pão se expande até atingir o volume desejado..
Referências
- Clark J. (2013). Outras leis de gás - Lei de Boyle e Lei de Charles. Recuperado de: chemguide.co.uk
- Staroscik Andrew. (2018). Lei de Charles. Recuperado de: scienceprimer.com
- Wikipedia. (2019). Charles Law. Recuperado de: en.wikipedia.org
- Helmenstine, Todd. (27 de dezembro de 2018). Qual é a fórmula da lei de Charles? Recuperado de: Thoughtco.com
- Prof. N. De Leon. (s.f.). Leis elementares dos gases: Charles Law. C 101 Class Notes. Recuperado de: iun.edu
- Briceño Gabriela. (2018). Charles Law. Recuperado de: euston96.com
- Morris, J. G. (1974). Físicoquímica para biólogos. (doisdá edição). Editorial Reverté, S.A.

Ainda sem comentários