
Unidade de medida e experimento da lei de Avogadro
O Lei de avogadro postula que um volume igual de todos os gases, à mesma temperatura e pressão, tem o mesmo número de moléculas. Amadeo Avogadro, um físico italiano, propôs duas hipóteses em 1811: a primeira diz que os átomos dos gases elementares estão juntos em moléculas em vez de existirem como átomos separados, como disse John Dalton..
A segunda hipótese diz que volumes iguais de gases a pressão e temperatura constantes têm o mesmo número de moléculas. A hipótese de Avogadro relacionada ao número de moléculas nos gases não foi aceita até 1858, quando o químico italiano Stanislao Cannizaro construiu um sistema lógico de química baseado nisso..

O seguinte pode ser deduzido da lei de Avogadro: para uma dada massa de um gás ideal, seu volume e o número de moléculas são diretamente proporcionais se a temperatura e a pressão forem constantes. Isso também implica que o volume molar de gases que se comportam de maneira ideal é o mesmo para todos.
Por exemplo, dado um número de balões, rotulados de A a Z, eles são todos cheios até que sejam inflados a um volume de 5 litros. Cada letra corresponde a uma espécie gasosa diferente; ou seja, suas moléculas têm características próprias. A lei de Avogadro afirma que todos os balões abrigam o mesmo número de moléculas.
Se os balões agora forem inflados para 10 litros, de acordo com as hipóteses de Avogadro, o dobro do número de moles gasosos iniciais terá sido introduzido.
Índice do artigo
- 1 Em que consiste e unidades de medida
- 1.1 Dedução do valor de R quando expresso em L atm / K mol
- 2 Forma usual da lei de Avogadro
- 3 Consequências e implicações
- 4 origens
- 4.1 Hipótese de Avogadro
- 4.2 Número de Avogadro
- 5 experimento de Avogadro
- 5.1 Experiência com contêineres comerciais
- 6 exemplos
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 referências
Em que consiste e unidades de medida
A lei de Avogadro afirma que, para uma massa de um gás ideal, o volume do gás e o número de moles são diretamente proporcionais se a temperatura e a pressão forem constantes. Matematicamente, pode ser expresso com a seguinte equação:
V / n = K
V = volume do gás, geralmente expresso em litros.
n = quantidade da substância medida em moles.
Além disso, da chamada lei dos gases ideais, temos o seguinte:
PV = nRT
P = pressão do gás é geralmente expressa em atmosferas (atm), em mm de mercúrio (mmHg) ou em Pascal (Pa).
V = o volume do gás expresso em litros (L).
n = número de moles.
T = a temperatura do gás expressa em graus Celsius, graus Fahrenheit ou graus Kelvin (0 ºC é igual a 273,15 K).
R = constante universal dos gases ideais, que pode ser expressa em várias unidades, dentre as quais se destacam: 0,08205 L atm / K. mol (L atm K-1.toupeira-1); 8,314 J / K. mol (J.K-1.toupeira-1) (J é joule); e 1.987 cal / Kmol (cal.K-1.toupeira-1) (cal são calorias).
Dedução do valor de R quando expresso em LAtm / KVerruga
O volume que um mol de um gás ocupa em uma atmosfera de pressão e 0 ºC equivalente a 273K é de 22.414 litros.
R = PV / T
R = 1 atm x 22.414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
A equação do gás ideal (PV = nRT) pode ser escrita da seguinte forma:
V / n = RT / P
Se a temperatura e a pressão forem assumidas como constantes, porque R é uma constante, então:
RT / P = K
Mais tarde:
V / n = K
Esta é uma consequência da lei de Avogadro: a existência de uma relação constante entre o volume que um gás ideal ocupa e o número de moles desse gás, para uma temperatura e pressão constantes..
Forma usual da lei de Avogadro
Se você tiver dois gases, a equação acima se tornará a seguinte:
V1/ n1= Vdois/ ndois
Esta expressão também é escrita como:
V1/ Vdois= n1/ ndois
O acima mostra a relação de proporcionalidade indicada.
Em sua hipótese, Avogadro apontou que dois gases ideais no mesmo volume e na mesma temperatura e pressão contêm o mesmo número de moléculas..
Por extensão, o mesmo é verdadeiro para gases reais; por exemplo, um volume igual de Odois e ndois contém o mesmo número de moléculas quando está na mesma temperatura e pressão.
Os gases reais apresentam pequenos desvios do comportamento ideal. No entanto, a lei de Avogadro é aproximadamente válida para gases reais em pressão baixa o suficiente e em altas temperaturas.
Consequências e implicações
A consequência mais significativa da lei de Avogadro é que a constante R para gases ideais tem o mesmo valor para todos os gases..
R = PV / nT
Portanto, se R é constante para dois gases:
P1V1/ nT1= PdoisVdois/ ndoisTdois = constante
Os sufixos 1 e 2 representam dois gases ideais diferentes. A conclusão é que a constante de gás ideal para 1 mol de um gás é independente da natureza do gás. Então, o volume ocupado por esta quantidade de gás em uma dada temperatura e pressão será sempre o mesmo.
Uma consequência da aplicação da lei de Avogadro é a constatação de que 1 mol de um gás ocupa um volume de 22.414 litros a uma pressão de 1 atmosfera e a uma temperatura de 0 ºC (273K).
Outra consequência óbvia é a seguinte: se a pressão e a temperatura são constantes, quando a quantidade de um gás aumenta, seu volume também aumenta..
origens
Em 1811, Avogadro apresentou sua hipótese com base na teoria atômica de Dalton e na lei de Gay-Lussac sobre os vetores de movimento das moléculas..
Gay-Lussac concluiu em 1809 que "os gases, em quaisquer proporções em que possam ser combinados, sempre dão origem a compostos cujos elementos medidos em volume são sempre múltiplos de outro".
O mesmo autor também mostrou que "combinações de gases sempre ocorrem de acordo com relações muito simples de volume".
Avogadro apontou que as reações químicas na fase gasosa envolvem espécies moleculares de reagentes e produtos..
De acordo com essa afirmação, a relação entre o reagente e as moléculas do produto deve ser um número inteiro, uma vez que a existência de quebra da ligação antes da reação (átomos individuais) não é provável. No entanto, as quantidades molares podem ser expressas com valores fracionários.
Por sua vez, a lei dos volumes de combinação indica que a relação numérica entre os volumes gasosos também é simples e inteira. Isso resulta em uma associação direta entre os volumes e o número de moléculas da espécie gasosa..
Hipótese de Avogadro
Avogadro propôs que as moléculas de gás eram diatômicas. Isso explicava como dois volumes de hidrogênio molecular se combinam com um volume de oxigênio molecular para dar dois volumes de água..
Além disso, Avogadro propôs que se volumes iguais de gases contivessem o mesmo número de partículas, a relação entre as densidades dos gases deveria ser igual à relação entre as massas moleculares dessas partículas..
Obviamente, dividir d1 por d2 dá origem ao quociente m1 / m2, uma vez que o volume ocupado pelas massas gasosas é o mesmo para as duas espécies e é cancelado:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Número de Avogadro
Um mol contém 6,022 x 102,3 moléculas ou átomos. Este número é chamado de número de Avogadro, embora não tenha sido ele quem o calculou. Jean Pierre, ganhador do Prêmio Nobel em 1926, fez as medições correspondentes e sugeriu o nome em homenagem a Avogadro.
Experimento de Avogadro
Uma demonstração muito simples da lei de Avogadro consiste em colocar ácido acético em uma garrafa de vidro e, em seguida, adicionar bicarbonato de sódio, fechando a boca da garrafa com um balão que impede a entrada ou saída de um gás de dentro da garrafa.
O ácido acético reage com o bicarbonato de sódio, liberando COdois. O gás se acumula no balão causando sua inflação. Teoricamente, o volume atingido pelo balão é proporcional ao número de moléculas de COdois, conforme declarado pela lei de Avogadro.
Porém, esse experimento tem uma limitação: o balão é um corpo elástico; portanto, à medida que sua parede se estica devido ao acúmulo de COdois, uma força é gerada neste que se opõe a sua distensão e tenta reduzir o volume do balão.
Experiência com contêineres comerciais
Outra experiência ilustrativa da lei de Avogadro é apresentada com o uso de latas de refrigerante e garrafas plásticas..
No caso das latas de refrigerante, o bicarbonato de sódio é despejado e, em seguida, é adicionada uma solução de ácido cítrico. Os compostos reagem entre si produzindo a liberação de gás COdois, que se acumula dentro da lata.
Em seguida, adiciona-se uma solução concentrada de hidróxido de sódio, que tem a função de "sequestrar" o CO.dois. O acesso ao interior da lata é então rapidamente fechado usando fita adesiva.
Após um certo tempo, observa-se que a lata se contrai, indicando que a presença de CO diminuiu.dois. Então, pode-se pensar que há uma diminuição no volume da lata que corresponde a uma diminuição no número de moléculas de CO.dois, de acordo com a lei de Avogadro.
No experimento com a garrafa, segue-se o mesmo procedimento da lata de refrigerante e, ao adicionar NaOH, fecha-se a boca da garrafa com a tampa; da mesma forma, uma contração da parede da garrafa é observada. Como resultado, a mesma análise pode ser realizada como no caso da lata de refrigerante..
Exemplos
As três imagens abaixo ilustram o conceito da lei de Avogadro, relacionando o volume que os gases ocupam e o número de moléculas de reagentes e produtos..
OUdois + 2hdois => 2HdoisOU
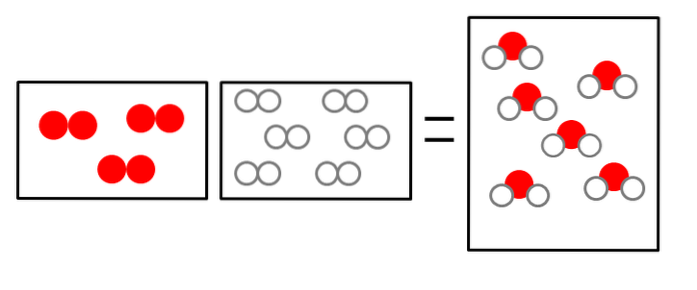
O volume do gás hidrogênio é o dobro, mas ocupa um recipiente do mesmo tamanho do oxigênio gasoso.
Ndois + 3Hdois => 2NH3
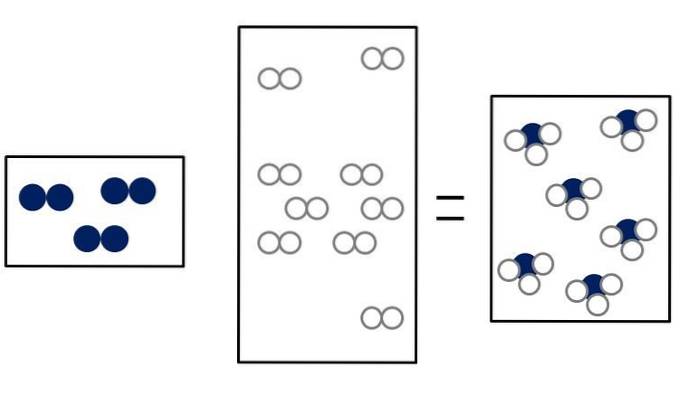
Ndois + OUdois => 2NO

Referências
- Bernard Fernandez, PhD. (Fevereiro de 2009). Duas hipóteses de Avogadro (1811). [PDF]. Retirado de: bibnum.education.fr
- Nuria Martínez Medina. (5 de julho de 2012). Avogadro, o grande cientista italiano do século XIX. Retirado de: rtve.es
- Muñoz R. e Bertomeu Sánchez J.R. (2003) A história da ciência nos livros didáticos: hipótese (s) de Avogadro, Ciências do ensino, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1 de fevereiro de 2018). O que é a lei de Avogadro? Retirado de: Thoughtco.com
- Os editores da Encyclopaedia Britannica. (2016, 26 de outubro). Lei de Avogadro. Encyclopædia Britannica. Retirado de: britannica.com
- Yang, S. P. (2002). Os produtos domésticos costumavam desmontar os contêineres e demonstrar a Lei de Avogadro. Chem. Educator. Vol: 7, páginas: 37-39.
- Glasstone, S. (1968). Tratado de Físico-Química. doisdá Ed. Aguilar Editorial.



Ainda sem comentários