
Estrutura, propriedades, usos do hidróxido de ferro (II)
O hidróxido de ferro (II), também chamado de hidróxido ferroso, é um composto inorgânico com a fórmula química Fe (OH)dois. Se sua pureza for alta, seu sólido consiste apenas de íonsdois+ e OH- em uma proporção de 2: 1; no entanto, pode conter moléculas de água e diferentes espécies iônicas, mudando a posição.
Representa a forma “reduzida” da famosa ferrugem, uma superfície avermelhada composta por íons Fe.3+; enquanto na ferrugem esverdeada, o Fe predominadois+, próximo ao OH- e outra quantidade de ânions: CO3dois-, SW4dois-, NÃO3- e haletos (F-, Cl-,… ), por exemplo. O resultado, embora a base desta ferrugem verde seja Fe (OH)dois, é que vários sólidos são obtidos.

Na vida diária, esse hidróxido pode ser visto em lugares comuns. Por exemplo, o barco da foto acima tem sua superfície coberta de ferrugem verde (não patina). Existe a fé (OH)dois, mas acompanhado por numerosos íons das ondas do mar.
Quimicamente falando, as propriedades e usos deste material dependem do cátion de Fe.dois+ e sua tendência de oxidar para se tornar o Fe3+. É um agente redutor, que reage rapidamente com o oxigênio em condições básicas. Portanto, deve ser usado em ambientes inertes e em soluções ácidas..
Índice do artigo
- 1 Estrutura do hidróxido de ferro (II)
- 1.1 Links
- 1.2 Camadas duplas de hidróxido
- 1.3 Hidratos
- 1.4 Ferrugem verde e vermelha
- 2 propriedades
- 3 usos
- 3.1 Análise orgânica qualitativa
- 3.2 Redutor de oxoanião de selênio
- 3.3 Materiais de camada dupla
- 4 referências
Estrutura do hidróxido de ferro (II)
Links
Considerando apenas Fe (OH)dois puro, não tem nada além de Fe ionsdois+ e OH-.
As interações entre eles devem, em teoria, ser iônicas por natureza; cada fraçãodois+ atrai dois ânions OH-, cujas atrações não direcionais acabam estabelecendo uma ordem estrutural e repetitiva que define um cristal; que por sua vez, dá origem a pó de ferrugem verde.
O problema é que há um certo caráter covalente entre os dois íons e, portanto, uma ligação Fe-OH iônica não pode ser ignorada. Considerando uma ligação Fe-OH parcialmente iônica, pode-se entender que elas estão agrupadas em uma espécie de camada polimérica.
Camadas duplas de hidróxido
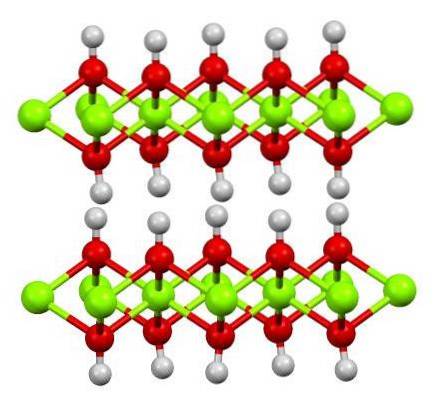
A estrutura do hidróxido ferroso puro é mostrada acima com um modelo ball-and-stick. As Fe caçõesdois+ são representados pelas esferas verdes brilhantes, enquanto os ânions OH- pelas esferas vermelhas e brancas. Observe como os íons se alinhamdois+ graças às interações (iônico-covalente) com o OH-.
Por que essa estrutura é chamada de camadas duplas de hidróxido? A própria imagem oferece a resposta: existem duas linhas ou camadas de OH- para cada um de fédois+; ou seja, a proporção de 2: 1 de Fe (OH) é mantidadois mencionado no início.
Unidades estruturais para Fe (OH)dois são então esses sanduíches, onde as camadas de OH- eles viriam a representar os pães; pães carregados negativamente que, portanto, falham em definir corretamente para definir um cristal marrom impressionante.
Mas, por outro lado, os átomos de H também se alinham e se obscurecem uns aos outros. Lembrando o conceito de polaridade e eletronegatividade, esses hidrogênios têm uma leve carga parcial positiva, δ +; que, embora fraco, pode ter uma zona positiva onde outros ânions ou moléculas estão alojados.
Hidratos
Quando o Fe (OH)dois se dissolve na água, suas moléculas se coordenam com o centro metálico do Fedois+ para formar um complexo aquoso: [Fe (HdoisOU)4(OH)dois] Este complexo tem uma geometria octaédrica porque possui seis ligantes: quatro moléculas de água e duas moléculas de OH.-. No entanto, no hidróxido ferroso hidratado o quadro é um pouco diferente..
No hidrato, da fórmula hipotética Fe (OH)doisNHdoisOu as moléculas de água estão alojadas exatamente entre as duas camadas de hidróxido; isto é, eles interagem por meio de forças de íons dipolo com hidrogênios ou esferas brancas. É como se dois sanduíches OHFeOH fossem agarrados e água fosse inserida para agrupá-los: OHFeOH (HdoisO) OHFeOH.
As moléculas de água são muito dinâmicas, evitando que as partículas de hidrato adquiram tamanhos consideráveis e, conseqüentemente, formem um sólido coloidal ou gelatinoso..
Ferrugem verde e vermelha
Nos hidratos, as camadas de hidróxido têm moléculas de água intercaladas; entretanto, eles podem ter outros ânions (já mencionados), causando uma grande variedade de ferrugens verdes. Da mesma forma, eles podem até "prender" moléculas tão grandes quanto DNA, ou drogas.
Não só os íons podem estar presentesdois+, mas também fé3+, produto da oxidação interna causada pelo oxigênio intercalado. Seria visivelmente observado que a ferrugem verde (ou óxido) começa a ficar avermelhada à medida que a concentração de Fe aumenta.3+.
Propriedades

Fe (OH) mostrado acimadois precipitado em um tubo de ensaio. Estando em água abundante, o aquoso complexo deve predominar sobre a estrutura que acabamos de mencionar. Observe que a superfície apresenta uma cor laranja, produto da oxidação do Fedois+ para a fé3+ pelo oxigênio do ar; ou seja, este hidróxido é um agente redutor:
Fédois+ <=> Fé3+ + e-
A aparência física deste composto em seu estado puro é a de um sólido marrom:

Que, dependendo do seu nível de umidade, pode aparecer como um sólido verde gelatinoso. É bastante insolúvel em água (Ksp= 8 10-16 e solubilidade = 0,72 g / 100mL a 25ºC), e tem uma massa molar de 89,86 g / mol e uma densidade de 3,4 g / mL.
Nenhum ponto de ebulição ou fusão é relatado para este composto; provavelmente devido ao fato de que, antes de uma fonte de calor, desidrata e se converte em óxido ferroso, FeO:
Fe (OH)dois => FeO + HdoisOU
Formulários
Análise orgânica qualitativa
Seu poder redutor é usado para determinar a presença de compostos nitro, RNOdois. A reação para a qual um teste positivo é obtido é representada pela seguinte equação química:
RNOdois + 6Fe (OH)dois + 4hdoisO => RNHdois + 6Fe (OH)3
O Fe (OH)3 precipita como um sólido marrom-avermelhado, que atesta a presença do grupo nitro, -NOdois.
Redutor de oxoanião de selênio
O poder redutor do Fe (OH)dois também tem sido usado para reduzir os ânions SeO3dois- (selenito) e SeO4dois- (selenato) em selênio elementar, Se. Na prática, permite a remoção desses ânions, prejudiciais à saúde, na forma de um sólido de selênio insolúvel e facilmente extraível..
Materiais de dupla camada
A sua estrutura pura, aliada à ferrugem verde, é fonte de inspiração para a concepção de novos materiais com características mineralógicas..
Estima-se que sua função seja permitir o transporte de uma espécie específica entre suas camadas, de forma que sua liberação para o sítio ativo (solos, células, superfície metálica, etc.) possa ser controlada ou reduzida..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Hidróxido de ferro (II). Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Hidróxido ferroso. Banco de dados PubChem. CID = 10129897. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Testes para Fenóis e Grupos Nitro. Química 211. Recuperado de: academics.wellesley.edu
- Clark Jim. (27 de abril de 2019). Química do ferro. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Kingston Technical Software. (2019). Rust Chemistry. Médicos da corrosão. Recuperado de: corrosion-doctors.org
- Zingaro, Ralph A. et al. (1997). Redução dos ânions oxoselênio pelo hidróxido de ferro (II). Environment International. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9

Ainda sem comentários