
Propriedades de gases, comportamento, forma, exemplos

O gases São todas aquelas substâncias ou compostos cujos estados de agregação são fracos e dispersos, ao mesmo tempo que dependem muito das condições de pressão e temperatura que os regem. Eles são talvez a segunda forma de matéria mais abundante em todo o Universo depois do plasma..
Na Terra, os gases constituem as camadas da atmosfera, desde a exosfera até a troposfera e o ar que respiramos. Embora um gás seja invisível quando se difunde em grandes espaços, como o céu, ele é detectado pelo movimento das nuvens, pelos giros das lâminas de um moinho ou pelos vapores exalados de nossas bocas em climas frios..

Da mesma forma, indo aos aspectos ambientais negativos, é observada na fumaça preta dos escapamentos dos veículos, nas colunas de fumaça das torres localizadas nas fábricas, ou na fumaça levantada quando uma floresta queima.
Você também está enfrentando fenômenos gasosos ao ver vapores que saem dos esgotos, nos fiapos de pântanos e cemitérios, no borbulhar dentro dos tanques de peixes, nos balões de hélio que são lançados para o céu, no oxigênio liberado pelas plantas como resultado de sua fotossíntese, e até mesmo em arrotos e flatulência.
Onde quer que sejam observados gases significa que houve uma reação química, a menos que sejam fixados ou assimilados diretamente do ar, principal fonte de gases (superficialmente) do planeta. À medida que a temperatura sobe, todas as substâncias (elementos químicos) se transformam em gases, incluindo metais como ferro, ouro e prata..
Independentemente da natureza química dos gases, todos eles compartilham em comum a grande distância que separa suas partículas (átomos, moléculas, íons, etc.), que se movem de forma caótica e arbitrária por um determinado volume ou espaço..
Índice do artigo
- 1 Propriedades dos gases
- 1.1 Físico
- 1.2 Condutividade elétrica e térmica
- 1.3 Reatividade
- 2 Comportamento dos gases
- 3 Forma de gases
- 4 Pressão de um gás
- 4.1 Unidades
- 5 Volume de um gás
- 6 principais leis de gás
- 6.1 Lei de Boyle
- 6.2 Charles Law
- 6.3 Lei de Gay-Lussac
- 6.4 Lei de Avogadro
- 7 tipos de gases
- 7.1 Gases combustíveis
- 7.2 Gases industriais
- 7.3 Gases inertes
- 8 Exemplos de elementos e compostos gasosos
- 8.1 Compostos gasosos
- 9 referências
Propriedades dos gases
Fisica
As propriedades físicas dos gases variam dependendo de qual substância ou composto está envolvido. Os gases são popularmente associados a maus odores ou putrefação, seja pelo teor de enxofre, seja pela presença de aminas voláteis. Da mesma forma, são visualizados com colorações esverdeadas, marrons ou amareladas, que intimidam e dão mau presságio..
No entanto, a maioria dos gases, ou pelo menos os mais abundantes, são na verdade incolores e inodoros. Embora sejam evasivos, podem ser sentidos na pele e resistem ao movimento, criando até camadas viscosas nos corpos que os atravessam (como acontece com os aviões)..
Todos os gases podem sofrer alterações de pressão ou temperatura que acabam por transformá-los em seus respectivos líquidos; ou seja, eles sofrem condensação (se forem resfriados) ou liquefação (se forem “pressionados”).

Por outro lado, os gases são capazes de se dissolver em líquidos e alguns sólidos porosos (como o carvão ativado). As bolhas são o resultado do acúmulo de gases que ainda não se dissolveram no meio e escapam para a superfície do líquido..
Condutividade elétrica e térmica
Em condições normais (sem ionização de suas partículas), os gases são maus condutores de calor e eletricidade. No entanto, quando estão estressados com muitos elétrons, eles permitem que a corrente passe por eles, como visto em relâmpagos durante tempestades..
Por outro lado, a baixas pressões e sujeitos a um campo elétrico, alguns gases, principalmente os nobres ou perfeitos, acendem-se e suas luzes são utilizadas para a concepção de anúncios e cartazes noturnos (luz neon), bem como na famosas lâmpadas de descarga elétrica em lanternas de rua.
Em relação à condutividade térmica, muitos gases se comportam como isolantes térmicos, portanto sua incorporação no enchimento de fibras, tecidos ou painéis de vidro ajuda a evitar a passagem de calor por eles e mantém a temperatura constante..
No entanto, existem gases que são bons condutores de calor e podem causar queimaduras piores do que as causadas por líquidos ou sólidos; por exemplo, como com o vapor quente de cupcakes assados (ou empanadas), ou de jatos de vapor que escapam de caldeiras.
Reatividade
Geralmente, as reações que envolvem gases, ou onde ocorrem, são classificadas como perigosas e complicadas.
Sua reatividade depende, novamente, de sua natureza química; Porém, ao expandir e mobilizar com grande facilidade, maior cuidado e controle devem ser exercidos, pois podem desencadear aumentos drásticos de pressão que colocam em risco a estrutura do reator; para não mencionar como gases inflamáveis ou não abençoadores são.
Comportamento dos gases
Macroscopicamente, pode-se ter uma ideia do comportamento dos gases testemunhando como a fumaça, os anéis ou as "línguas" literárias dos cigarros evoluem no ar. Da mesma forma, quando uma granada de fumaça explode, é interessante detalhar o movimento dessas nuvens de cores diferentes.
No entanto, tais observações estão sujeitas à ação do ar e também ao fato de haver partículas sólidas muito finas suspensas na fumaça. Portanto, esses exemplos não são suficientes para se chegar a uma conclusão sobre o verdadeiro comportamento de um gás. Em vez disso, experimentos foram realizados e a teoria cinética dos gases foi desenvolvida..
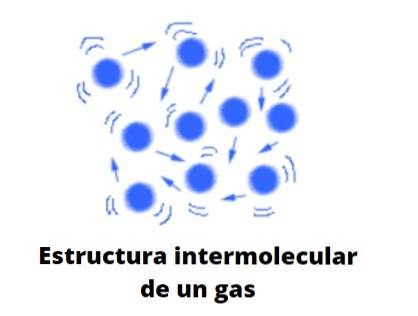
Molecularmente e idealmente, as partículas gasosas colidem elasticamente umas com as outras, apresentando deslocamentos lineares, rotacionais e vibracionais. Eles têm uma energia média associada, que lhes permite viajar livremente por qualquer espaço sem quase interagir ou colidir com outra partícula conforme o volume ao redor deles aumenta..
Seu comportamento viria a ser uma mistura do movimento errático browniano e as colisões de algumas bolas de bilhar que quicam incessantemente entre si e as paredes da mesa; se não houver paredes, eles se difundirão em direção ao infinito, a menos que sejam retidos por uma força: a gravidade.
Forma de gases
Os gases, ao contrário dos líquidos e sólidos, não são matéria do tipo condensado; ou seja, a agregação ou coesão de suas partículas nunca consegue definir uma forma. Compartilham com os líquidos o fato de ocuparem completamente o volume do recipiente que os contém; no entanto, eles não têm tensão superficial e superficial.
Se a concentração do gás for alta, suas “línguas” ou as formas macroscópicas já descritas podem ser vistas a olho nu. Estes, mais cedo ou mais tarde, acabarão sumindo pela ação do vento ou pela mera expansão do gás. Os gases, portanto, cobrem todos os cantos do espaço limitado originando sistemas altamente homogêneos.
Agora, a teoria considera convenientemente os gases como esferas que dificilmente colidem consigo mesmas; mas quando o fazem, eles saltam elasticamente.
Essas esferas são amplamente separadas umas das outras, de modo que os gases estão praticamente "cheios" de vácuo; daí sua versatilidade para passar pela menor fenda ou fissura, e a facilidade de ser capaz de comprimi-los significativamente.
Por isso, por mais fechada que esteja uma instalação de padaria, se você caminhar ao lado dela tem a certeza de que apreciará o aroma dos pães recém-assados..
Pressão de um gás
Pode-se acreditar que, pelo fato de as esferas ou partículas do gás estarem tão dispersas e separadas, elas são incapazes de gerar qualquer pressão sobre os corpos ou objetos. No entanto, a atmosfera prova que tal crença é falsa: ela tem massa, peso e impede que os líquidos evaporem ou fervam do nada. Os pontos de ebulição são medidos à pressão atmosférica.
As pressões de gás tornam-se mais quantificáveis se manômetros estiverem disponíveis, ou se eles forem colocados em recipientes com paredes não deformáveis. Assim, quanto mais partículas de gás houver dentro do recipiente, maior será o número de colisões entre elas e as paredes do recipiente..
Essas partículas, ao colidirem com as paredes, as pressionam, pois exercem uma força proporcional à sua energia cinética em sua superfície. É como se as bolas de bilhar ideais fossem atiradas contra uma parede; se houver muitos que os impactem em alta velocidade, pode até quebrar.
Unidades
Existem muitas unidades que acompanham as medições da pressão do gás. Alguns dos mais conhecidos são os milímetros de mercúrio (mmHg), como o torr. Existem aqueles do sistema internacional de unidades (SI) que definem o pascal (Pa) em termos de N / mdois; e dele, o quilo (kPa), mega (MPa) e giga (GPa) pascal.
Volume de um gás
Um gás ocupa e se expande por todo o volume do recipiente. Quanto maior o recipiente, o volume do gás também será; mas sua pressão e densidade diminuirão para a mesma quantidade de partículas.
O próprio gás, por outro lado, tem um volume associado que não depende tanto de sua natureza ou estrutura molecular (idealmente), mas das condições de pressão e temperatura que o governam; isto é, seu volume molar.
Na realidade, o volume molar varia de um gás para outro, embora as variações sejam pequenas se não forem moléculas grandes e heterogêneas. Por exemplo, o volume molar de amônia (NH3, 22.079 L / mol) a 0 ºC e 1 atm, difere do hélio (He, 22.435 L / mol).
Todos os gases têm um volume molar que muda em função de P e T e, por maiores que sejam suas partículas, o número delas é sempre o mesmo. De fato, a partir daqui ele derivou o que é conhecido pelo número de Avogadro (NPARA).
Principais leis de gás
O comportamento dos gases tem sido estudado há séculos por meio de experimentos, observações aprofundadas e interpretação dos resultados..
Tais experimentos permitiram estabelecer uma série de leis que, reunidas em uma mesma equação (a dos gases ideais), ajudam a predizer as respostas de um gás a diferentes condições de pressão e temperatura. Dessa forma, há uma relação entre seu volume, temperatura e pressão, bem como o número de seus moles em um determinado sistema..
Entre essas leis estão as quatro seguintes: Boyle, Charles, Gay-Lussac e Avogadro's.
Lei de Boyle
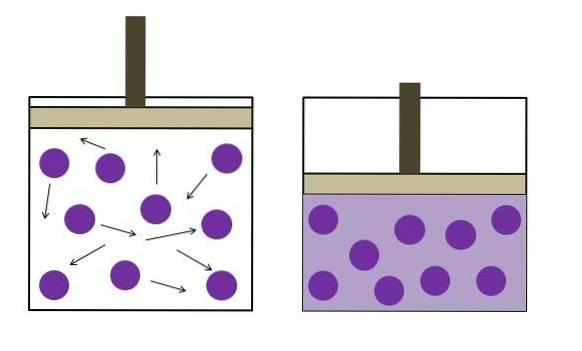
A lei de Boyle afirma que, em temperatura constante, o volume de um gás ideal é inversamente proporcional à sua pressão; ou seja, quanto maior o recipiente, menor a pressão que suas paredes sofrerão devido à mesma quantidade de gás..
Charles Law

A lei de Charles afirma que, em pressão constante, o volume de um gás ideal é diretamente proporcional à sua temperatura. Os balões demonstram a lei de Charles, porque se aquecidos inflam um pouco mais, ao passo que, se imersos em nitrogênio líquido, esvaziam porque o volume de gás dentro deles se contrai..
Lei Gay-Lussac
A lei de Gay-Lussac afirma que, em volume constante, a pressão de um gás ideal é diretamente proporcional à sua temperatura. Em um caldeirão bem fechado, se um gás for aquecido progressivamente, a cada vez a pressão dentro dele será maior, pois as paredes do caldeirão não se deformam nem se expandem; ou seja, seu volume não muda, é constante.
Lei de Avogadro
Finalmente, a lei de Avogadro afirma que o volume ocupado por um gás ideal é diretamente proporcional ao número de suas partículas. Assim, se tivermos um mole de partículas (6,02 · 102,3), teremos então o volume molar do gás.
Tipos de gases
Gases combustíveis
São aqueles gases cujos componentes funcionam como combustíveis, pois são utilizados para a produção de energia térmica. Alguns deles são gás natural, gás liquefeito de petróleo e hidrogênio.
Gases industriais
São aqueles gases manufaturados, que são comercializados ao público para diversos usos e aplicações, como nos setores de saúde, alimentação, proteção ambiental, metalurgia, indústria química, segurança, entre outros. Alguns desses gases são oxigênio, nitrogênio, hélio, cloro, hidrogênio, monóxido de carbono, propano, metano, óxido nitroso, entre outros..
Gases inertes
São aqueles gases que em condições específicas de temperatura e pressão, não geram nenhuma reação química ou muito baixa. Eles são neon, argônio, hélio, criptônio e xenônio. Eles são usados em processos químicos nos quais elementos não reativos são necessários.
Exemplos de elementos e compostos gasosos
Quais são os elementos gasosos da tabela periódica nas condições terrestres?
Primeiro temos o hidrogênio (H), que forma moléculas Hdois. O hélio (He), o gás nobre mais leve, segue; e então nitrogênio (N), oxigênio (O) e flúor (F). Estes três últimos também formam moléculas diatômicas: Ndois, OUdois e Fdois.
Depois do flúor, vem o néon (Ne), o gás nobre que segue o hélio. Abaixo do flúor temos o cloro (Cl), na forma de moléculas de Cldois.
A seguir temos o resto dos gases nobres: argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e oganésio (Og).
Portanto, eles são um total de doze elementos gasosos; onze se excluirmos o oganeson altamente radioativo e instável.
Compostos gasosos
Além dos elementos gasosos, alguns compostos gasosos comuns serão listados:
-HdoisSim, sulfeto de hidrogênio, responsável pelo cheiro de ovo podre
-NH3, amônia, aquele aroma pungente encontrado em sabonetes usados
-COdois, dióxido de carbono, um gás de efeito estufa
-NÃOdois, dióxido de nitrogênio
-NÃO, monóxido de nitrogênio, um gás que se acreditava ser altamente tóxico, mas desempenha um papel importante no sistema circulatório
-SW3, trióxido de enxofre
-C4H10, butano
-HCl, cloreto de hidrogênio
-OU3, ozônio
-SF6, hexafluoreto de enxofre
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- As propriedades dos gases. Recuperado de: chemed.chem.purdue.edu
- Wikipedia. (2019). Gás. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5 de dezembro de 2018). Gases - Propriedades Gerais dos Gases. Recuperado de: Thoughtco.com
- Harvard Men's Health Watch. (2019). O estado do gás. Recuperado de: health.harvard.edu
- Editores de refrigeração eletrônica. (1 de setembro de 1998). A condutividade térmica dos gases. Recuperado de: electronics-cooling.com



Ainda sem comentários