
Características, estrutura, funções da Fucosa
O fucose (abreviado Fuc), ou 6-L-desoxigalactose, é um monossacarídeo de seis carbonos parcialmente desoxigenado (desoxi-açúcar) cuja fórmula empírica é C6H12OU5. Como outros monossacarídeos, é um açúcar poli-hídrico.
Quando um grupo hidroxila é substituído por um átomo de hidrogênio, um desoxi açúcar é derivado. Embora teoricamente essa substituição possa afetar qualquer grupo hidroxila de qualquer monossacarídeo, na natureza há pouca variedade de desoxissacarídeos.
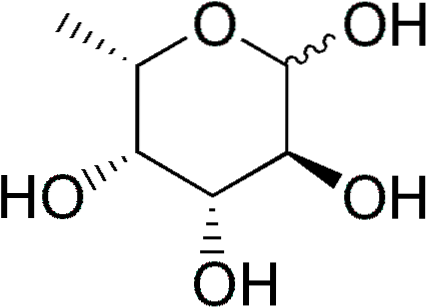
Alguns desoxi-açúcares são: 1) desoxirribose (2-desoxi-D-ribose), derivada da D-ribose, que faz parte do DNA; 2) ramnose (6-D-desoximanose), derivada de D-manose; 3) fucose, derivada de L-galactose. Este último é mais comum que a D-fucose, derivada da D-galactose.
Índice do artigo
- 1 Características e estrutura
- 2 Distribuição na natureza
- 3 Metabolismo da fucose
- 4 funções
- 4.1 Papel no câncer
- 4.2 Papel em outras doenças
- 4.3 Potencial biomédico
- 5 referências
Características e estrutura
A fucose também é conhecida pelos nomes 6-desoxigalacto-hexose, fucopiranose, galactometilose e rodeose..
Embora normalmente encontrado na formação de polissacarídeos e glicoproteínas, isolado como um monossacarídeo é mais doce que a galactose. Isso se deve ao fato de que a substituição de um grupo hidroxila por um átomo de hidrogênio aumenta o caráter hidrofóbico e, portanto, a doçura da molécula..
Os grupos hidroxila da fucose podem sofrer as mesmas reações que outros açúcares, produzindo uma grande variedade de acetais, glicosídeos, éteres e ésteres..
Uma biomolécula fucosilada é aquela à qual, pela ação de uma fucosiltransferase, as moléculas de fucose foram anexadas por meio de ligações glicosídicas. Quando ocorre a hidrólise das ligações glicosídicas pela ação de uma fucosidase, separando assim a fucose, a biomolécula teria sido desfucosilada.
Quando os glucanos são fucosilados, são gerados glucanos mais complexos chamados fucanos, que podem ou não fazer parte das glicoproteínas. Os fucanos sulfatados são definidos como os polissacarídeos que contêm resíduos de L-fucose sulfatados. Eles são típicos de algas marrons. Os exemplos incluem ascofilano, sargasano e pelvetano..
Um dos fucanos mais bem estudados é o fucoidano, obtido a partir de algas marrons Fucus vesiculosus, que tem sido comercializado (Sigma-Aldrich Chemical Company) por décadas.
Distribuição na natureza
A D-fucose está presente em substâncias antibióticas produzidas por micróbios e em glicosídeos vegetais, como convolvulina, chartreusina, ledienosídeo e querotoxina.
L-fucose é um constituinte de polissacarídeos de algas, folhas de ameixa, linho, soja e sementes de canola, goma tragacanta, paredes celulares de batata, tubérculos de mandioca, kiwi, casca de ceiba e mucigel do caliptra de milho, bem como outras plantas.
A L-fucose também está presente em ovos de ouriço-do-mar e na gelatina que protege os ovos de rã.
Em mamíferos, os fucanos com L-fucose formam os ligantes que atuam na adesão leucócito-endotelial mediada por selectina e participam de vários eventos ontogenéticos.
A L-fucose é abundante nos fucosfingolipídios do epitélio gastrointestinal e da medula óssea, e aparece em pequenas proporções na cartilagem e estruturas queratinosas.
Em humanos, a L-fucose fucana faz parte das glicoproteínas da saliva e do suco gástrico. Eles também fazem parte dos antígenos que definem os grupos sanguíneos ABO. Eles estão presentes em vários oligossacarídeos no leite materno.
Metabolismo da fucose
As fucosiltransferases usam GDP-fucose, uma forma de fucose ativada por nucleotídeo, como um doador de fucose na construção de oligossacarídeos fucosilados.
A GDP-fucose é derivada da GDP-manose pela ação sucessiva de duas enzimas: a GDP-manose 4,6-desidratase e a GDP-4-ceto-6-desoximanose 3,5-epimerase-4-redutase.
Usando um cofator NADP +, a primeira enzima catalisa a desidratação da GDP-manose. A redução da posição 6 e a oxidação da posição 4 produzem GDP-6-desoxi-4-ceto-manose (durante a reação, o híbrido é transferido da posição 4 para 6 do açúcar).
A segunda enzima, dependente de NADPH, catalisa a epimerização das posições 3 e 5, e a redução do grupo 4-ceto, da GDP-6-desoxi-4-ceto-manose..
As bactérias podem crescer usando a fucose como única fonte de carbono e energia por meio de um operon indutível por fucose que codifica enzimas catabólicas para esse açúcar..
O processo acima envolve: 1) entrada de fucose livre através da parede celular mediada por uma permease; 2) isomerização de fucose (uma aldose) para formar fuculose (uma cetose); 3) fosforilação de fuculose para formar fuculose-1-fosfato; 4) uma reação de aldolase para formar lactaldeído e fosfato de dihidroxiacetona a partir de fuculose-1-fosfato.
Características
Papel no câncer
Os sintomas de muitos tipos de tumores cancerosos incluem a presença de proteínas ligadas ao glucano que se distinguem por terem uma composição de oligossacarídeo alterada. A presença desses glucanos anormais, entre os quais se destacam os fucanos, está ligada à malignidade e potencial metastático desses tumores..
No câncer de mama, as células tumorais incorporam fucose em glicoproteínas e glicolipídeos. A fucose contribui para a progressão desse câncer, favorecendo a ativação de células-tronco cancerígenas, metástases hematogênicas e a invasão de tumores através de matrizes extracelulares.
No carcinoma de pulmão e na hepatocarcinogênese, o aumento da expressão de fucose está associado a um alto potencial metastático e uma baixa probabilidade de sobrevivência.
Em contraste, alguns fucanos sulfatados são substâncias promissoras no tratamento do câncer, conforme foi determinado por vários estudos in vitro com linhagens de células cancerosas, incluindo aquelas que causam câncer de mama, pulmão, próstata, gástrico, cólon e reto..
Papel em outras doenças
O aumento da expressão de fucanos em imunoglobulinas séricas foi associado à artrite reumatóide juvenil e adulta.
A deficiência de adesão de leucócitos II é uma doença congênita rara devido a mutações que alteram a atividade de um transportador FDP-fucose localizado no aparelho de Golgi.
Os pacientes sofrem de retardo mental e psicomotor e sofrem de infecções bacterianas recorrentes. Esta doença responde favoravelmente a doses orais de fucose.
Potencial biomédico
Os fucanos sulfatados obtidos a partir de algas marrons são importantes reservatórios de compostos com potencial terapêutico.
Apresentam propriedades antiinflamatórias e antioxidantes, inibindo a migração de linfócitos nos locais de infecção e favorecendo a liberação de citocinas. Aumenta a resposta imunológica ativando linfócitos e macrófagos.
Eles têm propriedades anticoagulantes. Oralmente mostrado para inibir a agregação plaquetária em pacientes humanos.
Eles têm potencial antibiótico e antiparasitário e inibem o crescimento de bactérias patogênicas do estômago Helicobacter pylori. Matar parasitas Plasmodium spp. (agente causador da malária) e Leishmania donovani (agente causador da leishmaniose viscerotrópica americana).
Por fim, possuem poderosas propriedades antivirais, inibindo a entrada na célula de diversos vírus de grande importância para a saúde humana, incluindo Arenavirus, Citomegalovírus, Hantavírus, Hepadnavirus, HIV, vírus herpes simplex e vírus influenza.
Referências
- Becker, D. J., Lowe, J. B. 2003. Fucose: biossíntese e função biológica em mamíferos. Glicobiologia, 13, 41R-53R.
- Deniaud-Bouët, E., Hardouin, K., Potin, P., Kloareg, B., Hervé, C. 2017. Uma revisão sobre paredes celulares de algas marrons e polissacarídeos sulfatados contendo fucose: contexto da parede celular, propriedades biomédicas e chave pesquisa desafia Carbohydrate Polymers, http://dx.doi.org/10.1016/j.carbpol.2017.07.082.
- Flowers H. M. 1981. Química e bioquímica de D- e L-fucose. Advances in Carbohydrate Chemistry and Biochemistry, 39, 279-345.
- Listinsky, J. J., Siegal, G. P., Listinsky, C. M. 2011. A importância emergente de α-L-fucose no câncer de mama humano: uma revisão. Am. J. Transl. Res., 3, 292-322.
- Murray, R. K., et al. 2003. Bioquímica ilustrada de Harper. McGraw-Hill, Nova York.
- Pereira, L. 2018. Uso terapêutico e nutricional das algas. CRC Press, Boca Raton.
- Staudacher, E., Altmann, F., Wilson, I. B. H., März, L. 1999. Fucose in N-glycans: from plant to man. Biochimica et Biophysica Acta, 1473, 216-236.
- Tanner, W., Loewus, F. A. 1981. Plant carbohydrates II. Carboidratos extracelulares. Springer, Nova York.
- Vanhooren, P. T., Vandamme, E. J. 1999. L-fucose: ocorrência, papel fisiológico, síntese química, enzimática e microbiana. Journal of Chemical Technology and Biotechnology, 74, 479-497.


Ainda sem comentários