
Propriedades, riscos e usos do ácido arsênico (H3AsO4)
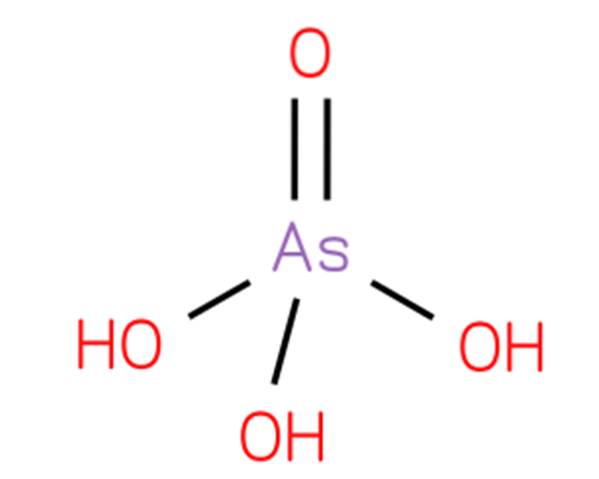
O ácido arsênico, hidrogênio arseniato ou ácido ortoarsênico, é um composto químico cuja fórmula é H3AsO4. Um oxácido de arsênio compreende um grupo oxo e três grupos hidroxila ligados a um átomo de arsênio central. Sua estrutura é apresentada na figura 1 (CHEBI: 18231 - ácido arsênico, S.F.).
Sua estrutura é análoga ao ácido fosfórico (Royal Society of Chemistry, 2015) e pode ser reescrita como AsO (OH) 3. Este composto é preparado tratando trióxido de arsênio com óxido nítrico de acordo com a reação: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
A solução resultante é resfriada para dar cristais incolores do hemi-hidrato H3AsO4 · ½H2O, embora o di-hidrato H3AsO4 · 2H2O ocorra quando a cristalização ocorre em temperaturas mais baixas (Budavari, 1996).
O ácido arsênico é um composto extremamente tóxico. Muitas fichas de dados de segurança aconselham evitar o contato, se possível.
Índice do artigo
- 1 Propriedades físicas e químicas do ácido arsênico
- 2 Reatividade e perigos
- 2.1 Em caso de contato com os olhos
- 2.2 Em caso de contato com a pele
- 2.3 Em caso de ingestão
- 2.4 Em caso de inalação
- 3 usos
- 4 referências
Propriedades físicas e químicas do ácido arsênico
O ácido arsênico é um sólido higroscópico branco. Sua aparência é mostrada na figura 2.

Em solução aquosa, é um líquido higroscópico viscoso e transparente (National Center for Biotechnology Information., 2017). Seu peso molecular é 141,94 g / mol e sua densidade é 2,5 g / ml. Seu ponto de fusão é 35,5 ° C e seu ponto de ebulição é 120 ° C onde se decompõe.
O ácido arsênico é muito solúvel em água, sendo capaz de dissolver 16,7 g por 100 ml, também é solúvel em álcool. O composto tem um pKa de 2,19 para a primeira desprotonação e 6,94 e 11,5 para a segunda e terceira deprotonação (Royal Society of Chemistry, 2015).
O ácido arsênico é um agente oxidante. Pode corroer aço e reage com metais galvanizados e latão.
As soluções de ácido arsênico podem desenvolver arsina gasosa muito tóxica (AsH3) em contato com metais ativos, como zinco e alumínio. Quando aquecido até a decomposição, produz vapores tóxicos de arsênio metálico.
A solução é ligeiramente ácida e um agente oxidante fraco. Reage com álcalis para gerar algum calor e precipitar arsenatos (ARSENIC ACID, LIQUID, 2016).
Reatividade e perigos
O ácido arsênico é um composto estável e não combustível que pode ser corrosivo para os metais. O composto é altamente tóxico e comprovadamente cancerígeno para humanos.
A inalação, ingestão ou contato da pele com o material pode causar ferimentos graves ou morte. O contato com a substância fundida pode causar queimaduras graves na pele e nos olhos..
Evite o contato com a pele. Os efeitos do contato ou inalação podem ser retardados. O fogo pode produzir gases irritantes, corrosivos e / ou tóxicos. A água residual do produto de diluição ou controle de incêndio pode ser corrosiva e / ou tóxica e causar contaminação.
Os sintomas de envenenamento por ácido arsênico são tosse e falta de ar se inalado. Também pode haver vermelhidão na pele, dor e uma sensação de queimação se entrar em contato com ela. Finalmente, os sintomas em caso de ingestão são vermelhidão e dor nos olhos, dor de garganta, náuseas, vômitos, diarréia e convulsões..
Em caso de contato com os olhos
Devem ser lavados com água em abundância por pelo menos 15 minutos, levantando-se esporadicamente as pálpebras superior e inferior até que não haja mais vestígios de produtos químicos..
Em caso de contato com a pele
Lave imediatamente com bastante água e sabão por pelo menos 15 minutos enquanto remove roupas e sapatos contaminados. Cubra as queimaduras com um curativo esterilizado seco (seguro, não apertado).
Em caso de ingestão
Enxaguar a boca e dar à vítima consciente grandes quantidades de água para diluir o ácido. Nesse caso, deve-se fazer lavagem gástrica e não se deve induzir o vômito..
Em caso de inalação
Deve-se administrar respiração artificial, se necessário. O método boca-a-boca não deve ser usado se a vítima tiver ingerido ou inalado a substância..
A respiração artificial deve ser realizada com o auxílio de uma máscara de bolso equipada com uma válvula unidirecional ou outro dispositivo médico respiratório adequado. A vítima deve ser removida para um local fresco e mantida aquecida e em repouso..
Em todos os casos, deve-se procurar atendimento médico imediato (Instituto Nacional de Segurança e Saúde Ocupacional, 2015).
O ácido arsênico é prejudicial ao meio ambiente. A substância é muito tóxica para os organismos aquáticos. Devem ser tomadas medidas para limitar a liberação deste composto químico.
Formulários
O ácido arsênico, devido à sua alta toxicidade, tem usos limitados. No entanto, este composto foi usado como pesticida e esterilizante do solo, embora esteja atualmente obsoleto (University of Hertfordshire, 2016).
Também tem sido usado no processamento de madeira e como dessecante na produção de algodão desde 1995. Pulverizar as plantas faz com que as folhas sequem rapidamente, sem cair. A planta precisa estar seca o suficiente para que as cápsulas do algodão possam sair facilmente.
O ácido arsênico é usado na produção de vidro. Embora os registros considerem a substância como intermediário, esse uso do ácido arsênico parece mais um “agente de processamento”, semelhante ao uso do trióxido diarsênico (As2O3) como agente finalizador..
Este composto rompe as ligações de oxigênio entre outros elementos por meio da reação redox e produz oxigênio gasoso que ajuda a eliminar bolhas no vidro (documento de posicionamento das Indústrias de Vidros Européias no, 2012).
O ácido arsanílico ou ácido 4-aminofenilarsônico é um derivado do ácido ortoarsênico. É usado como um medicamento veterinário antibacteriano arsênico usado na prevenção e tratamento da disenteria suína (ARSENIC ACID, S.F.).
O arsenato é o sal ou éster do ácido arsênico que possui um íon negativo do AsO43-. O arsenato se assemelha ao fosfato de muitas maneiras, uma vez que o arsênio e o fósforo ocorrem no mesmo grupo (coluna) da tabela periódica..
O arsenato pode substituir o fosfato inorgânico no estágio de glicólise que produz 1,3-bisfosfoglicerato, produzindo 1-arsênio-3-fosfoglicerato. Esta molécula é instável e hidrolisa rapidamente, formando o próximo intermediário ao longo do caminho, o 3-fosfoglicerato..
Portanto, a glicólise continua, mas a molécula de ATP que seria gerada a partir do 1,3-bisfosfoglicerato é perdida. O arseniato é um desacoplador da glicólise, o que explica sua toxicidade.
Algumas espécies de bactérias obtêm sua energia oxidando vários combustíveis enquanto reduzem o arseniato para formar arsenitos. As enzimas envolvidas são conhecidas como redutases de arseniato..
Em 2008, foram descobertas bactérias que empregam uma versão da fotossíntese com arsenitos como doadores de elétrons, produzindo arseniato (assim como a fotossíntese comum usa água como doador de elétrons, produzindo oxigênio molecular).
Os pesquisadores conjeturaram que, historicamente, esses organismos fotossintéticos produziram o arseniato que permitiu que as bactérias redutoras de arseniato prosperassem (Human Metabolome Database, 2017).
Referências
- ÁCIDO ARSÊNICO. (S.F.). Recuperado de chemicalland21.com.
- ÁCIDO ARSÊNICO, LÍQUIDO. (2016). Recuperado de cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co.
- CHEBI: 18231 - ácido arsênico. (S.F.). Recuperado de ebi.ac.uk.
- Human Metabolome Database. (2017, 2 de março). Mostrando metabocard para Arsenate. Recuperado de hmdb.ca.
- National Center for Biotechnology Information… (2017, 4 de março). PubChem Compound Database; CID = 234,. Obtido em PubChem.
- Instituto Nacional de Segurança e Saúde Ocupacional. (2015, 22 de julho). ÁCIDO ARSÊNICO. Recuperado de cdc.gov.
- Documento de Posição das Indústrias de Vidro Européias sobre o. (2012, 18 de setembro). Recuperado da glassallianceeurope.
- Royal Society of Chemistry. (2015). Ácido arsênico. Recuperado de chemspider.
- Royal Society of Chemistry. (2015). Ácido fosfórico. Recuperado de chemspider.
- University of Hertfordshire. (2016, 13 de janeiro). ácido arsênico. Recuperado do PPDB.



Ainda sem comentários