
Estrutura, propriedades, usos, riscos do fosforeto de alumínio (AIP)
O fosforeto de alumínio É um composto inorgânico formado por um átomo de alumínio (Al) e um átomo de fósforo (P). Sua fórmula química é AlP. É um cinza escuro sólido ou, se muito puro, amarelo. É um composto extremamente tóxico para os seres vivos.
O fosforeto de alumínio reage com a umidade para formar fosfina ou fosfano PH3, que é um gás venenoso. Por isso, o AlP não deve entrar em contato com a água. Reage fortemente com ácidos e soluções alcalinas.

Era usado no passado para eliminar pragas como insetos e roedores em locais onde grãos de cereais e outros produtos agrícolas eram armazenados. No entanto, devido ao seu alto perigo, foi proibido na maioria dos países do mundo..
Atualmente, sua utilidade na área de eletrônica está sendo investigada teoricamente por meio de computadores que calculam a possibilidade de obtenção de nanotubos de AlP semicondutores, ou seja, tubos extremamente pequenos que podem transmitir eletricidade apenas em determinadas condições..
O fosforeto de alumínio é um composto muito perigoso, deve ser manuseado com instrumentos de segurança como luvas, óculos, respiradores e roupas de proteção..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3.6 Propriedades químicas
- 3.7 Outras propriedades
- 4 Obtendo
- 5 usos
- 5.1 Na eliminação de pragas (uso descontinuado)
- 5.2 Em outras aplicações
- 6 Investigação teórica de nanotubos de AlP
- 6.1 Nanotubos de AlP com boro
- 6.2 Nanotubos de AlP com estrutura alterada
- 7 riscos
- 8 referências
Estrutura
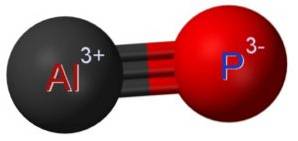
O fosforeto de alumínio AlP é formado pela união de um átomo de alumínio Al e um átomo de fósforo P. A ligação entre ambos é covalente e tripla, portanto é muito forte.
O alumínio em AlP tem um estado de oxidação de +3 e o fósforo tem uma valência de -3.
Nomenclatura
- Fosforeto de Alumínio
Propriedades
Estado físico
Sólido cristalino cinza escuro ou amarelo escuro ou verde. Cristais cúbicos.
Peso molecular
57,9553 g / mol
Ponto de fusão
2550 ºC
Densidade
2,40 g / cm3 a 25 ° C
Solubilidade
Decompõe-se na água.
Propriedades quimicas
Reage com a umidade para dar fosfina ou fosfano PH3 que é um composto inflamável e venenoso. Fosfina ou fosfano se inflama espontaneamente em contato com o ar, exceto se houver excesso de água.
A reação de fosforeto de alumínio com água é a seguinte:
Fosfeto de Alumínio + Água → Hidróxido de Alumínio + Fosfina
AlP + 3 HdoisO → Al (OH)3 + PH3↑
As apresentações comerciais contam com carbonato de alumínio Aldois(CO3)3 para evitar a autoignição da fosfina que ocorre quando o AlP entra em contato com a umidade do ar.
O AlP é estável quando seco. Reage violentamente com ácidos e soluções alcalinas.
O Fosfeto de Alumínio AlP não derrete, sublima ou se decompõe termicamente em temperaturas de até 1000 ° C. Mesmo nessa temperatura, sua pressão de vapor é muito baixa, ou seja, não evapora nessa temperatura..
Quando aquecido até a decomposição, emite óxidos de fósforo tóxicos. Em contato com metais, pode emitir gases de hidrogênio inflamáveis Hdois.
Outras propriedades
Quando puro apresenta coloração amarelada, ao se misturar com resíduos da reação do preparo apresenta coloração que vai do cinza ao preto..
Sua baixa volatilidade o impede de ter qualquer odor, então o cheiro de alho que ele às vezes emite é devido ao PH de fosfina3 que se forma na presença de umidade.
Obtendo
O fosforeto de alumínio pode ser obtido por aquecimento de uma mistura de alumínio metálico em pó (Al) e o elemento de fósforo vermelho (P).
Devido à afinidade do fósforo (P) pelo oxigênio (Odois) e o de alumínio (Al) por oxigênio e nitrogênio (Ndois), a reação deve ser realizada em uma atmosfera livre desses gases, por exemplo, em uma atmosfera de hidrogênio (Hdois) ou gás natural.
A reação é iniciada aquecendo rapidamente uma zona da mistura até o início da reação, que é exotérmica (calor é produzido durante a reação). A partir desse momento, a reação prossegue rapidamente.
Alumínio + Fósforo → Fosfeto de Alumínio
4 Al + P4 → 4 AlP
Formulários
Na eliminação de pragas (uso descontinuado)
O fosforeto de alumínio foi usado no passado como inseticida e como um assassino de roedores. No entanto, embora tenha sido proibido por sua toxidade, ainda é usado em algumas partes do mundo..
É utilizado para fumigação em espaços fechados onde existem produtos agrícolas alimentares processados ou não transformados (como cereais), ração animal e produtos não alimentares.
O objetivo é controlar insetos e roedores que atacam os itens armazenados, sejam comestíveis ou não..
Permite controlar roedores e insetos em áreas não domésticas, agrícolas ou não agrícolas, pulverizando ao ar livre ou em suas tocas e ninhos para evitar que transmitam certas doenças.


Sua forma de uso consiste em expor o AlP ao ar ou à umidade, desde que seja liberado fosfina ou fosfano PH.3 que danifica muitos órgãos da praga a ser eliminada.

Em outros aplicativos
Fosfeto de alumínio AlP é usado como fonte de fosfina ou fosfano PH3 e está sendo usado na pesquisa de semicondutores.
Investigação teórica de nanotubos de AlP
Foram realizados estudos teóricos sobre a formação de nanotubos de AlP de fosfeto de alumínio. Os nanotubos são cilindros muito pequenos e muito finos que podem ser visíveis apenas com um microscópio eletrônico..
Nanotubos de AlP com boro
Estudos teóricos realizados por meio de cálculos computacionais mostram que as impurezas que poderiam ser adicionadas aos nanotubos de AlP poderiam alterar as propriedades teóricas destes..
Por exemplo, estima-se que a adição de átomos de boro (B) aos nanotubos de AlP poderia transformá-los em semicondutores do tipo-p. Um semicondutor é um material que se comporta como condutor de eletricidade ou como isolante dependendo do campo elétrico ao qual está sujeito.
E um tipo de semicondutor-p É quando as impurezas são adicionadas ao material, neste caso o AlP é o material de partida e os átomos de boro seriam as impurezas. Semicondutores são úteis para aplicações eletrônicas.
Nanotubos de AlP com estrutura alterada
Alguns cientistas realizaram cálculos para determinar o efeito da mudança da estrutura cristalina dos nanotubos de AlP de hexagonal para octaédrico..
Eles descobriram que a manipulação da estrutura da rede poderia ser usada para ajustar a condutividade e reatividade dos nanotubos de AlP e projetá-los para serem úteis em aplicações eletrônicas e ópticas..
Riscos
O contato com o fosfeto de alumínio pode irritar a pele, os olhos e as membranas mucosas. Se ingerido ou inalado, é tóxico. Pode ser absorvido pela pele com efeitos tóxicos.
Se o AlP entrar em contato com a água, ele reage e forma fosfina ou fosfano PH3 que é extremamente inflamável, pois se inflama em contato com o ar. Portanto, pode explodir. Além disso, a fosfina causa a morte de humanos e animais.
Como o fosforeto de alumínio é um pesticida barato, seu uso é uma causa comum de envenenamento em pessoas e acarreta uma alta taxa de mortalidade.

Reage com a umidade das membranas mucosas e com o ácido clorídrico HCl no estômago, formando o muito tóxico gás fosfano PH3. Portanto, por inalação e ingestão, a fosfina é formada no corpo, com efeitos fatais..
Sua ingestão causa sangramento do trato gastrointestinal, colapso cardiovascular, distúrbios neuropsiquiátricos, insuficiência respiratória e renal em poucas horas..
AlP é muito tóxico para todos os animais terrestres e aquáticos.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Fosforeto de alumínio. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Alumínio. Outros compostos de alumínio. Em Handbook on the Toxicology of Metals (Terceira Edição). Recuperado de sciencedirect.com.
- Gupta, R.C. e Crissman, J.W. (2013). Avaliação de segurança incluindo questões atuais e emergentes em patologia toxicológica. Risco Humano. No Handbook of Toxicology Pathology de Haschek e Rousseaux (terceira edição). Recuperado de sciencedirect.com.
- White, W.E. e Bushey, A.H. (1944). Fosfeto de Alumínio - Preparação e Composição. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Recuperado de pubs.acs.org.
- Mirzaei, Maryam e Mirzaei, Mahmoud. (2011). Um estudo teórico de nanotubos de fosfeto de alumínio dopados com boro. Computational and Theoretical Chemistry 963 (2011) 294-297. Recuperado de sciencedirect.com.
- Takahashi, L. e Takahashi, K. (2018). Ajustando a Estrutura Eletrônica de um Nanotubo de Fosfeto de Alumínio através da Configuração da Geometria da Treliça. ACS Appl. Nano Mater. 2018, 1, 501-504. Recuperado de pubs.acs.org.
- Gupta, P.K. (2016). Efeitos tóxicos de pesticidas (agroquímicos). Fosfeto de Alumínio. Em Fundamentals of Toxicology. Recuperado de sciencedirect.com.


Ainda sem comentários