
Estrutura, propriedades, síntese e usos do fluoreto de magnésio
O fluoreto de magnésio é um sal inorgânico incolor cuja fórmula química é MgF₂. É encontrado na natureza como o mineral selaíta. Tem um ponto de fusão muito alto e é muito pouco solúvel em água. É relativamente inerte, pois, por exemplo, sua reação com o ácido sulfúrico é lenta e incompleta e resiste à hidrólise com ácido fluorídrico (HF) até 750ºC..
É um composto pouco afetado pela radiação de alta energia. Além disso, tem baixo índice de refração, alta resistência à corrosão, boa estabilidade térmica, dureza significativa e excelentes propriedades de transmissão de luz visível, UV (ultravioleta) e IR (infravermelho)..
Essas propriedades fazem com que ele tenha excelente desempenho no campo óptico e, além disso, o tornam um material útil como suporte de catalisador, elemento de revestimento, lentes anti-reflexivas e janelas para transmissão infravermelha, entre outras aplicações..
Índice do artigo
- 1 Estrutura
- 2 propriedades
- 3 Síntese e preparação
- 4 usos
- 4.1 Óptica
- 4.2 Catálise ou aceleração de reações
- 4.3 Outros usos
- 5 referências
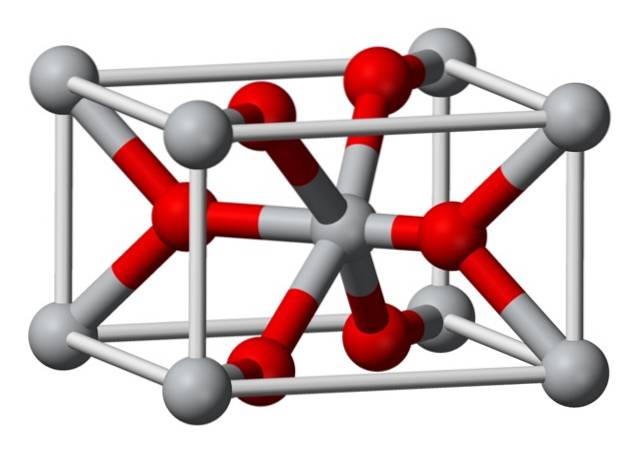
Estrutura
A estrutura cristalina do fluoreto de magnésio quimicamente preparado é do mesmo tipo que a do mineral natural selaíta. Cristaliza na classe dipiramidal do sistema tetragonal.
Os íons magnésio (Mg2 +) estão localizados em um espaço de rede tetragonal centrado, enquanto os íons fluoreto (F-) são encontrados no mesmo plano e associados aos seus vizinhos Mg2 +, agrupados em pares. A distância entre os íons Mg2 + e F- é 2,07 Å (angstroms) (2,07 × 10-10m).
Sua coordenação de cristal é 6: 3. Isso significa que cada íon Mg2 + é circundado por 6 íons F- e cada íon F-, por sua vez, é circundado por 3 íons Mg2 + 5..
A estrutura é muito semelhante à do mineral rutilo, que é a forma natural do dióxido de titânio (TiO2), com o qual possui várias propriedades cristalográficas em comum..
Durante sua produção, o fluoreto de magnésio não precipita como um sólido amorfo, porque os íons Mg2 + e F- não tendem a formar complexos poliméricos em solução..
Propriedades
Curiosamente, o fluoreto de magnésio é um material birrefringente. Esta é uma propriedade ótica que permite que um raio de luz incidente seja dividido em dois raios separados que se propagam em diferentes velocidades e comprimentos de onda..
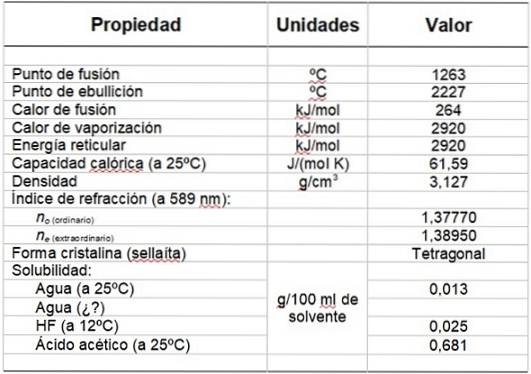
A Tabela 1 mostra algumas de suas propriedades.
Tabela 1. Propriedades físicas e químicas do fluoreto de magnésio.
Síntese e preparação
Pode ser preparado de várias maneiras, incluindo as seguintes:
1-Por meio da reação entre óxido de magnésio (MgO) ou carbonato de magnésio (MgCO3) com ácido fluorídrico (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-Por reação entre carbonato de magnésio e bifluoreto de amônio (NH4HF2), ambos no estado sólido, a uma temperatura entre 150 e 400ºC2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Aquecimento de uma solução aquosa de carbonato de magnésio e fluoreto de amônio (NH4F) na presença de hidróxido de amônio (NH4OH) a 60ºC 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
O precipitado resultante de fluoreto de magnésio e amônio (NH4MgF3) é então aquecido a 620 ° C durante 4 horas para obter fluoreto de magnésio:
620ºC
NH4MgF3 MgF2 + NH3 + HF
4-Como subproduto da obtenção de berílio (Be) e urânio (U). O fluoreto do elemento desejado é aquecido com magnésio metálico em um cadinho revestido com MgF2 2:
BeF2 + Mg Be + MgF2
5-Reagindo cloreto de magnésio (MgCl2) com fluoreto de amônio (NH4F) em solução aquosa à temperatura ambiente 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Como os métodos de preparação do MgF2 são caros, há tentativas de obtê-lo de maneira mais econômica, entre as quais se destaca o método de produção a partir da água do mar..
Este é caracterizado por adicionar uma quantidade suficiente de íons fluoreto (F-) à água do mar, que possui uma concentração abundante de íons magnésio (Mg2 +), favorecendo a precipitação do MgF2..
Cristais ópticos de fluoreto de magnésio são obtidos por prensagem a quente de pó de MgF2 de alta qualidade, obtido, por exemplo, pelo método NH4HF2.
Existem muitas técnicas para preparar materiais de fluoreto de magnésio, como crescimento de cristal único, sinterização (compactação para moldar ou modelagem) sem pressão, prensagem a quente e sinterização por micro-ondas..
Formulários
Óptica
Os cristais de MgF2 são adequados para aplicações ópticas porque são transparentes da região UV para a região IV média 2.10.
Como um filme inerte, é usado para alterar as propriedades de transmissão de luz de materiais óticos e eletrônicos. Uma das principais aplicações é em ótica VUV para tecnologia de exploração espacial.
Devido à sua propriedade de birrefringência, este material é útil em óptica de polarização, em janelas e prismas do Excimer Laser (um tipo de laser ultravioleta utilizado em cirurgia ocular)..
Deve-se observar que o fluoreto de magnésio utilizado na fabricação de materiais ópticos de filme fino deve estar livre de impurezas ou compostos que sejam fonte de óxido, como água (H2O), íons hidróxido (OH-), íons carbonato (CO3 = ), íons sulfato (SO4 =) e semelhantes 12.
Catálise ou aceleração de reações
O MgF2 tem sido usado com sucesso como um suporte de catalisador para a reação de eliminação de cloro e adição de hidrogênio em CFCs (clorofluorcarbonos), refrigerantes conhecidos e propelentes de aerossol, e responsável pelos danos à camada de ozônio da atmosfera.
Os compostos resultantes, HFC (hidrofluorocarbonos) e HCFC (hidroclorofluorocarbonos), não apresentam este efeito nocivo à atmosfera 5.
Também tem sido útil como um suporte de catalisador para a hidrodessulfurização (remoção de enxofre) de compostos orgânicos..
Outros usos
Os materiais gerados pela intercalação de grafite, flúor e MgF2 apresentam alta condutividade elétrica, razão pela qual têm sido propostos para uso em cátodos e como materiais eletrocondutores..
O eutético formado por NaF e MgF2 possui propriedades de armazenamento de energia na forma de calor latente, razão pela qual tem sido considerado para uso em sistemas de energia solar..
Na área da bioquímica, o fluoreto de magnésio, junto com outros fluoretos de metal, é usado para inibir as reações de transferência de fosforil em enzimas..
Recentemente, nanopartículas de MgF2 foram testadas com sucesso como vetores de distribuição de drogas em células doentes para o tratamento de câncer..
Referências
- Buckley, H.E. e Vernon, W.S. (1925) XCIV. A estrutura cristalina do fluoreto de magnésio. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Volume 11, Quinta Edição, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; e Song, Jinhong. (2015). Preparação de cerâmica translúcida de MgF2 por sinterização por prensagem a quente. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 No. 4.
- Непоклонов, И.С. (2011). Fluoreto de magnésio. Fonte: Trabalho próprio.
- Wojciechowska, Maria; Zielinski, Michal; e Pietrowski, Mariusz. (2003). MgF2 como suporte de catalisador não convencional. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoreto de magnésio (MgF2). Recuperado em 12/07/2019 em: korth.de
- Sevonkaev, Igor e Matijevic, Egon. (2009). Formação de partículas de fluoreto de magnésio de diferentes morfologias. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Fluoreto de magnésio. Fonte: Trabalho próprio.
- Tao Qin, Peng Zhang e Weiwei Qin. (2017). Um novo método para sintetizar esferas de fluoreto de magnésio de baixo custo a partir da água do mar. Ceramics International 43 (2017) 14481-14483.
- Enciclopédia de Química Industrial de Ullmann (1996) Quinta Edição. Volume A11. VCH Verlagsgesellschaft mbH. Nova york. ISBN 0-89573-161-4.
- NASA (2013). Engenheiros inspecionando o espelho primário do Telescópio Espacial Hubble 8109563. Fonte: mix.msfc.nasa.gov



Ainda sem comentários