
História, propriedades, estrutura, obtenção, riscos, usos do flúor
O flúor É um elemento químico representado pelo símbolo F e pelo grupo de cabeças 17, ao qual pertencem os halogênios. Distingue-se acima dos demais elementos da tabela periódica, por ser o mais reativo e eletronegativo; reage com quase todos os átomos, por isso forma inúmeros sais e compostos organofluorados.
Em condições normais, é um gás amarelo claro, que pode ser confundido com verde amarelado. No estado líquido, mostrado na imagem abaixo, sua cor amarela se intensifica um pouco mais, que desaparece completamente quando se solidifica no ponto de congelamento..

Tal é sua reatividade, apesar da natureza volátil de seu gás, que permanece preso na crosta terrestre; principalmente na forma do mineral fluorita, conhecido por seus cristais violetas. Da mesma forma, sua reatividade o torna uma substância potencialmente perigosa; reage vigorosamente a tudo que toca e arde em chamas.
No entanto, muitos de seus subprodutos podem ser inofensivos e até benéficos, dependendo de suas aplicações. Por exemplo, o uso mais popular de flúor, adicionado em sua forma iônica ou mineral (como sais de flúor), é a preparação de dentifrícios com flúor, que ajudam a proteger o esmalte dos dentes..
O flúor tem a peculiaridade de poder estabilizar os altos números ou estados de oxidação de muitos outros elementos. Quanto maior o número de átomos de flúor, mais reativo é o composto (a menos que seja um polímero). Da mesma forma, seus efeitos com matrizes moleculares aumentarão; Para o bem ou para o mal.
Índice do artigo
- 1 história
- 1.1 Uso de fluorita
- 1.2 Preparação de ácido fluorídrico
- 1.3 Isolamento
- 1.4 Interesse em flúor
- 2 Propriedades físicas e químicas
- 2.1 Aparência
- 2.2 Número atômico (Z)
- 2.3 Peso atômico
- 2.4 Ponto de fusão
- 2,5 ponto de ebulição
- 2.6 Densidade
- 2.7 Calor de vaporização
- Capacidade de calor de 2,8 molares
- 2.9 Pressão de vapor
- 2.10 Condutividade térmica
- 2.11 Ordem magnética
- 2,12 Odor
- 2,13 números de oxidação
- 2.14 Energia de ionização
- 2.15 Eletronegatividade
- 2.16 Agente oxidante
- 2.17 Reatividade
- 3 Estrutura e configuração eletrônica
- 3.1 Molécula diatômica
- 3.2 Líquido e sólido
- 4 Onde encontrar e obter
- 4.1 Processamento de fluorita
- 4.2 Eletrólise de fluoreto de hidrogênio
- 5 isótopos
- 6 papel biológico
- 7 riscos
- 7.1 Fluorose dentária
- 7.2 Fluorose esquelética
- 8 usos
- 8.1 Cremes dentais
- 8.2 Fluoretação da água
- 8.3 Agente oxidante
- 8.4 Polímeros
- 8.5 Farmacêuticos
- 8.6 Gravação de vidro
- 8.7 Enriquecimento de urânio
- 9 referências
História
Uso de fluorita
Em 1530, o mineralogista alemão Georgius Agricola descobriu que o mineral fluorita poderia ser usado na purificação de metais. O fluorita é outro nome para fluorita, um mineral de flúor que consistia em fluoreto de cálcio (CaFdois).
O elemento flúor ainda não havia sido descoberto e o "fluoir" na fluorita veio da palavra latina "fluere", que significa "fluir"; já que isso era precisamente o que fluorita ou fluorita fazia com os metais: ajudou-os a deixar a amostra.
Preparação de ácido fluorídrico
Em 1764, Andreas Sigismud Margraff conseguiu preparar o ácido fluorídrico, aquecendo a fluorita com ácido sulfúrico. As retortas de vidro foram derretidas pela ação do ácido, então o vidro foi substituído por metais.
Também é atribuída a Carl Scheele, em 1771, a preparação do ácido pelo mesmo método seguido por Margraff. Em 1809, o cientista francês Andre-Marie Ampere propôs que o ácido fluorídrico ou fluorídrico era um composto feito de hidrogênio e um novo elemento semelhante ao cloro..
Os cientistas tentaram isolar o flúor usando ácido fluorídrico por um longo tempo; mas sua perigosidade tornava o progresso neste sentido difícil.
Humphry Davy, Joseph Louis Gay-Lussac e Jacques Thénard tiveram fortes dores ao inalar o fluoreto de hidrogênio (ácido fluorídrico sem água e na forma gasosa). Os cientistas Paulin Louyet e Jerome Nickles morreram de envenenamento em circunstâncias semelhantes.
Edmond Frémy, um pesquisador francês, tentou criar ácido fluorídrico seco para evitar a toxicidade do fluoreto de hidrogênio acidificando o bifluoreto de potássio (KHFdois), mas durante a eletrólise não houve condução da corrente elétrica.
Isolamento
Em 1860, o químico inglês George Gore tentou a eletrólise do ácido fluorídrico seco e conseguiu isolar uma pequena quantidade do gás flúor. No entanto, ocorreu uma explosão quando o hidrogênio e o flúor se recombinaram violentamente. Gore atribuiu a explosão a um vazamento de oxigênio..
Em 1886, o químico francês Henri Moisson conseguiu isolar o flúor pela primeira vez. Anteriormente, o trabalho de Moisson foi interrompido quatro vezes por envenenamento severo com fluoreto de hidrogênio, enquanto tentava isolar o elemento..
Moisson foi aluno de Frémy e confiou em seus experimentos para isolar o flúor. Moisson usou uma mistura de fluoreto de potássio e ácido fluorídrico na eletrólise. A solução resultante conduziu eletricidade e gás flúor coletado no ânodo; ou seja, no eletrodo carregado positivamente.
Moisson usava equipamentos resistentes à corrosão, nos quais os eletrodos eram feitos de uma liga de platina e irídio. Na eletrólise, ele usou um recipiente de platina e resfriou a solução eletrolítica a uma temperatura de -23ºF (-31ºC)..
Finalmente, em 26 de junho de 1886, Henri Moissson conseguiu isolar o flúor, trabalho que lhe permitiu ganhar o Prêmio Nobel em 1906.
Interesse em flúor
O interesse pela pesquisa sobre flúor foi perdido por um tempo. Porém, o desenvolvimento do Projeto Manhattan para a produção da bomba atômica, impulsionou-o novamente.
A americana Dupont desenvolveu, entre os anos 1930 e 1940, produtos fluorados como os clorofluorcarbonos (Freon-12), usados como refrigerantes; e o plástico de politetrafluoroetileno, mais conhecido pelo nome de Teflon. Isso produziu um aumento na produção e no consumo de flúor..
Em 1986, em uma conferência cerca de um século depois do isolamento do flúor, o químico americano Karl O. Christe apresentou um método químico para a preparação do flúor pela reação entre KdoisMnF6 e o SbF5.
Propriedades físicas e químicas
Aparência
O flúor é um gás amarelo claro. No estado líquido, é amarelo brilhante. Enquanto isso, o sólido pode ser opaco (alfa) ou transparente (beta).
Número atômico (Z)
9.
Peso atômico
18.998 u.
Ponto de fusão
-219,67 ºC.
Ponto de ebulição
-188,11 ºC.
Densidade
À temperatura ambiente: 1,696 g / L.
No ponto de fusão (líquido): 1,505 g / mL.
Calor da vaporização
6,51 kJ / mol.
Capacidade de calor molar
31 J / (mol K).
Pressão de vapor
A uma temperatura de 58 K, tem uma pressão de vapor de 986,92 atm.
Condutividade térmica
0,0277 W / (m K)
Ordem magnética
Diamagnético
Odor
Odor pungente e pungente característico, detectável mesmo a 20 ppb.
Números de oxidação
-1, que corresponde ao ânion fluoreto, F-.
Energia de ionização
-Primeiro: 1.681 kJ / mol
-Segundo: 3.374 kJ / mol
-Terceiro: 6.147 KJ / mol
Eletro-negatividade
3,98 na escala de Pauling.
É o elemento químico com as maiores eletronegatividades; ou seja, ele tem uma alta afinidade com os elétrons dos átomos com os quais se liga. Por causa disso, os átomos de flúor geram grandes momentos de dipolo em regiões específicas de uma molécula..
Sua eletronegatividade também tem outro efeito: os átomos ligados a ele perdem tanta densidade de elétrons que começam a adquirir carga positiva; isto é, um número de oxidação positivo. Quanto mais átomos de flúor houver em um composto, o átomo central terá um número de oxidação mais positivo..
Por exemplo, no OFdois oxigênio tem um número de oxidação de +2 (Odois+Fdois-); na UF6, O urânio tem um número de oxidação de +6 (U6+F6-); o mesmo acontece com o enxofre em SF6 (S6+F6-); e finalmente há o AgFdois, onde a prata ainda tem um número de oxidação de +2, raro para ela.
Portanto, os elementos conseguem participar com seus números de oxidação mais positivos quando formam compostos com o flúor..
Agente oxidante
O flúor é o elemento oxidante mais poderoso, portanto nenhuma substância é capaz de oxidá-lo; e por esta razão, não é encontrado gratuitamente na natureza.
Reatividade
O flúor é capaz de se combinar com todos os outros elementos, exceto hélio, néon e argônio. Também não ataca aço-carbono ou cobre em temperaturas normais. Reage violentamente com materiais orgânicos como borracha, madeira e tecido.
O flúor pode reagir com o gás nobre xenônio para formar o forte difluoreto de xenônio oxidante, XeFdois. Ele também reage com o hidrogênio para formar um haleto, fluoreto de hidrogênio, HF. Por sua vez, o fluoreto de hidrogênio se dissolve na água para produzir o famoso ácido fluorídrico (como vidro).
A acidez dos ácidos ácidos, classificados em ordem crescente é:
HF < HCl < HBr < HI
O ácido nítrico reage com o flúor para formar nitrato de flúor, FNO3. Enquanto isso, o ácido clorídrico reage vigorosamente com flúor para formar HF, OFdois e ClF3.
Estrutura e configuração eletrônica

Molécula diatômica

O átomo de flúor em seu estado fundamental possui sete elétrons de valência, que estão nos orbitais 2s e 2p de acordo com a configuração eletrônica:
[He] 2sdois 2 P5
A teoria da ligação de valência (VTE) afirma que dois átomos de flúor, F, são covalentemente ligados para completar seu octeto de valência.
Isso acontece rapidamente porque leva apenas um elétron para se tornar isoeletrônico ao gás nobre do néon; e seus átomos são muito pequenos, com uma carga nuclear efetiva muito forte que facilmente exige elétrons do ambiente.
A molécula Fdois (imagem superior), tem uma única ligação covalente, F-F. Apesar de sua estabilidade em comparação com os átomos de F livres, é uma molécula altamente reativa; homonuclear, apolar e ávido por elétrons. É por isso que o flúor, como o Fdois, é uma espécie muito tóxica e perigosa.
Porque o Fdois é apolar, suas interações dependem de sua massa molecular e das forças de dispersão de Londres. Em algum ponto, a nuvem eletrônica em torno de ambos os átomos F deve se deformar e originar um dipolo instantâneo que induz outro em uma molécula vizinha; de modo que eles se atraiam lentamente e fracamente.
Líquido e Sólido
A molécula Fdois é muito pequeno e se difunde no espaço com relativa rapidez. Em sua fase gasosa, apresenta uma cor amarela pálida (que pode ser confundida com um verde limão). Quando a temperatura cai para -188 ºC, as forças de dispersão tornam-se mais eficazes e fazem com que as moléculas Fdois coalescer o suficiente para definir um líquido.
O flúor líquido (primeira imagem) parece ainda mais amarelo do que seu respectivo gás. Nele, as moléculas Fdois eles estão mais próximos e interagem com a luz em um grau maior. Curiosamente, uma vez que o cristal de flúor cúbico distorcido se forma a -220 ° C, a cor desbota e permanece como um sólido transparente..
Agora que as moléculas Fdois estão tão próximos (mas sem suas rotações moleculares parando), parece que seus elétrons ganham uma certa estabilidade e, portanto, seu salto eletrônico é muito grande para a luz interagir com o cristal..
Fases cristalinas
Este cristal cúbico corresponde à fase β (não é um alótropo porque ainda é o mesmo Fdois) Quando a temperatura cai ainda mais, até -228 ºC, o flúor sólido sofre uma transição de fase; o cristal cúbico torna-se monoclínico, a fase α:
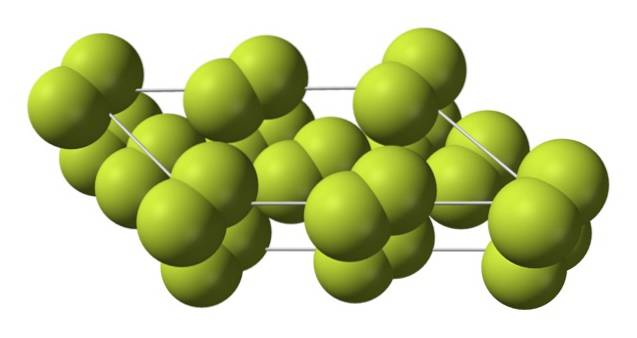
Ao contrário de β-Fdois, o α-Fdois é opaco e duro. Talvez seja porque as moléculas Fdois eles não têm mais tanta liberdade para girar em suas posições fixas em cristais monoclínicos; onde interagem em maior grau com a luz, mas sem excitar seus elétrons (o que explicaria superficialmente sua opacidade).
A estrutura cristalina de α-Fdois era difícil de estudar por métodos convencionais de difração de raios X. Isso porque a transição da fase β para a fase α é altamente exotérmica; então o cristal praticamente explodiu, ao mesmo tempo que teve pouca interação com a radiação.
Demorou cerca de cinquenta anos até que os cientistas alemães (Florian Kraus et al.) Decifrassem totalmente a estrutura de α-Fdois mais precisamente graças às técnicas de difração de nêutrons.
Onde encontrar e obter
O flúor ocupa a 24ª posição entre os elementos mais comuns do Universo. No entanto, na Terra é massa 13vo elemento, com uma concentração de 950 ppm na crosta terrestre e uma concentração de 1,3 ppm na água do mar.
Os solos têm uma concentração de flúor entre 150 e 400 ppm, e em alguns solos a concentração pode chegar a 1.000 ppm. No ar atmosférico está presente em uma concentração de 0,6 ppb; mas foi registrado em algumas cidades em até 50 ppb.
O flúor é obtido principalmente a partir de três minerais: fluorita ou fluorospar (CaFdois), fluoroapatita [Ca5(PO4)3F] e criolita (Na3AlF6).
Processamento de fluorita
Após a coleta das rochas com o mineral fluorita, elas são submetidas a um esmagamento primário e secundário. Com a britagem secundária, fragmentos de rocha muito pequenos são obtidos.
Os fragmentos de rocha são então levados para um moinho de bolas para serem reduzidos a pó. Água e reagentes são adicionados para formar uma pasta, que é colocada em um tanque de flutuação. O ar é injetado sob pressão para formar bolhas e, assim, a fluorita acaba flutuando na superfície aquosa.
Os silicatos e carbonatos se depositam enquanto a fluorita é coletada e levada para os fornos de secagem..
Uma vez que a fluorita é obtida, ela reage com ácido sulfúrico para produzir fluoreto de hidrogênio:
CaFdois + HdoisSW4 => 2 HF + CaSO4
Eletrólise de fluoreto de hidrogênio
Na produção do flúor, segue-se o método usado por Moisson em 1886, com algumas modificações..
Uma eletrólise é feita de uma mistura de fluoreto de potássio fundido e ácido fluorídrico, com uma razão molar de 1: 2,0 a 1: 2,2. A temperatura do sal fundido é 70 - 130 ºC.
O cátodo consiste em uma liga de Monel ou aço, e o ânodo é degrafita de carbono. O processo de produção de flúor durante a eletrólise pode ser descrito da seguinte forma:
2HF => Hdois + Fdois
Água é usada para resfriar a câmara de eletrólise, mas a temperatura deve estar acima do ponto de fusão do eletrólito para evitar a solidificação. O hidrogênio produzido na eletrólise é coletado no cátodo, enquanto o flúor no ânodo.
Isótopos
O flúor possui 18 isótopos, sendo o 19F é o único isótopo estável com abundância de 100%. O 18F tem meia-vida de 109,77 minutos e é o isótopo radioativo do flúor com a meia-vida mais longa. O 18F é usado como fonte de pósitrons.
Papel biológico
Não há atividade metabólica conhecida do flúor em mamíferos ou plantas superiores. No entanto, algumas plantas e esponjas marinhas sintetizam monofluoroacetato, um composto venenoso, que usam como proteção para evitar sua destruição.
Riscos
O consumo excessivo de flúor tem sido associado à fluorose óssea em adultos e à fluorose dentária em crianças, além de alterações na função renal. Por esse motivo, o Serviço de Saúde Pública dos Estados Unidos (PHS) sugeriu que a concentração de flúor na água potável não deve ser superior a 0,7 mg / L.
Enquanto isso, The Us Enviromental Protection Agency (EPA) estabeleceu que a concentração de flúor na água potável não deve ser superior a 4mg / L, a fim de evitar a fluorose esquelética, na qual o flúor se acumula nos ossos. Isso pode levar ao enfraquecimento do osso e fraturas..
O flúor foi associado a danos à glândula paratireoide, com diminuição do cálcio nas estruturas ósseas e altas concentrações de cálcio no plasma.
Entre as alterações atribuídas ao excesso de flúor estão: fluorose dentária, fluorose esquelética e danos à glândula paratireoide..
Fluorose dentária
A fluorose dentária ocorre com pequenas estrias ou manchas no esmalte do dente. Crianças menores de 6 anos não devem usar colutórios que contenham flúor..
Fluorose esquelética
Na fluorose esquelética, podem ser diagnosticados dores e lesões nos ossos, bem como nas articulações. O osso pode endurecer e perder elasticidade, aumentando o risco de fraturas.
Formulários
Pasta de dentes

Começamos com a seção sobre os usos do flúor com aquele mais conhecido: servir como componente de muitos cremes dentais. Este não é o único uso em que o contraste entre sua molécula F é apreciadodois, extremamente venenoso e perigoso, e o ânion F-, que dependendo do seu ambiente pode ser benéfico (embora às vezes não).
Quando comemos alimentos, especialmente doces, as bactérias os decompõem aumentando a acidez de nossa saliva. Então chega um ponto em que o pH é ácido o suficiente para degradar e desmineralizar o esmalte dos dentes; hidroxiapatita se decompõe.
No entanto, neste processo, os íons F- interagir com Cadois+ para formar uma matriz de fluorapatita; mais estável e durável do que a hidroxiapatita. Ou, pelo menos, esse é o mecanismo proposto para explicar a ação do ânion flúor nos dentes. É provável que seja mais complexo e tenha um equilíbrio hidroxiapatita-fluorapatita dependente do pH.
Esses ânions F- Eles estão disponíveis em plantas dentais na forma de sais; tais como: NaF, SnFdois (o famoso fluoreto estanoso) e NaPOF. No entanto, a concentração de F- Deve ser baixo (menos de 0,2%), caso contrário causa efeitos negativos no corpo.
Fluoretação da água
Muito parecido com a pasta de dente, os sais de flúor foram adicionados às fontes de água potável para combater as cáries em quem a bebe. A concentração ainda deve ser muito menor (0,7 ppm). No entanto, esta prática é frequentemente objeto de desconfiança e controvérsia, pois têm sido atribuídos possíveis efeitos cancerígenos..
Agente oxidante
Gás Fdois ele se comporta como um agente oxidante muito forte. Isso faz com que muitos compostos queimem mais rápido do que quando expostos ao oxigênio e a uma fonte de calor. É por isso que tem sido usado em misturas de combustível de foguete, em que pode até substituir o ozônio.
Polímeros
Em muitos usos, as contribuições do flúor não são devidas ao Fdois ou F-, mas diretamente para seus átomos eletronegativos como parte de um composto orgânico. Em essência, falamos de um link C-F..
Dependendo da estrutura, polímeros ou fibras com ligações C-F são geralmente hidrofóbicos, portanto, não se molham ou resistem ao ataque do ácido fluorídrico; Ou, melhor ainda, podem ser excelentes isolantes elétricos e materiais úteis com os quais objetos como tubos e gaxetas são feitos. Teflon e nafion são exemplos desses polímeros fluorados.
Farmacêuticos
A reatividade do flúor torna seu uso para a síntese de múltiplos compostos de flúor, orgânicos ou inorgânicos, questionável. Em orgânicos, especificamente aqueles com efeitos farmacológicos, a substituição de um de seus heteroátomos por átomos de F aumenta (positiva ou negativamente) sua ação sobre seu alvo biológico..
É por isso que na indústria farmacêutica a modificação de alguns medicamentos com a adição de átomos de flúor está sempre na mesa..
Muito semelhante acontece com herbicidas e fungicidas. O flúor neles pode aumentar sua ação e eficácia em insetos e pragas fúngicas..
Gravura em vidro
O ácido fluorídrico, por sua agressividade com o vidro e a cerâmica, tem sido utilizado para gravar peças finas e delicadas desses materiais; geralmente destinado à fabricação de microcomponentes de computadores, ou para lâmpadas elétricas.
Enriquecimento de urânio
Um dos usos mais relevantes do flúor elementar é ajudar a enriquecer o urânio como 235U. Para isso, os minerais de urânio são dissolvidos em ácido fluorídrico, produzindo UF4. Este fluoreto inorgânico então reage com o Fdois, para assim se transformar em UF6 (235PHEW6 Y 238PHEW6).
Posteriormente, e por centrifugação de gás, o 235PHEW6 separa de 238PHEW6 para depois ser oxidado e armazenado como combustível nuclear.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Krämer Katrina. (2019). Estrutura do flúor congelado revisitada após 50 anos. The Royal Society of Chemistry. Recuperado de: chemicalworld.com
- Wikipedia. (2019). Flúor. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Flúor. Banco de dados PubChem. CID = 24524. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fatos sobre o elemento flúor. Chemicool. Recuperado de: chemicool.com
- Batul Nafisa Baxamusa. (2018, 21 de fevereiro). Os usos surpreendentemente comuns do flúor altamente reativo. Recuperado de: sciencestruck.com
- Paola Opazo Sáez. (4 de fevereiro de 2019). Flúor na pasta de dentes: faz bem ou faz mal à saúde? Recuperado de: nacionfarma.com
- Karl Christe e Stefan Schneider. (8 de maio de 2019). Flúor: elemento químico. Encyclopædia Britannica. Recuperado de: britannica.com
- Lenntech B.V. (2019). Tabela periódica: oxigênio. Recuperado de: lenntech.com
- Gagnon Steve. (s.f.). O elemento flúor. Jefferson Lab. Recuperado de: education.jlab.org
- Equipe de conteúdo médico e editorial da American Cancer Society. (2015, 28 de julho). Fluoretação da água e risco de câncer. Recuperado de: cancer.org



Ainda sem comentários