
História, descrição e conclusões da experiência de Rutherford
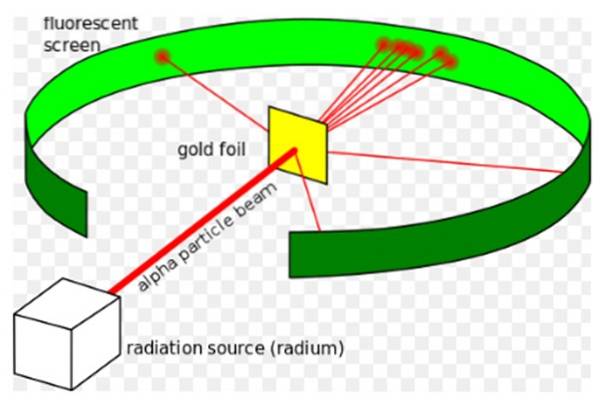
O Experimento Rutherford, realizado entre 1908 e 1913, consistia em bombardear uma fina folha de ouro de 0,0004 mm de espessura com partículas alfa e analisar o padrão de dispersão que essas partículas deixavam em uma tela fluorescente..
Na verdade, Rutherford conduziu vários experimentos, refinando cada vez mais os detalhes. Depois de analisar cuidadosamente os resultados, emergiram duas conclusões muito importantes:
-A carga positiva do átomo está concentrada em uma região chamada testemunho.
-Este núcleo atômico é incrivelmente pequeno em comparação com o tamanho do átomo.
Ernest Rutherford (1871-1937) foi um físico nascido na Nova Zelândia, cujo campo de interesse era a radioatividade e a natureza da matéria. A radioatividade era um fenômeno recente quando Rutherford começou seus experimentos, ela foi descoberta por Henri Becquerel em 1896.
Em 1907, Rutherford foi para a Universidade de Manchester, na Inglaterra, para estudar a estrutura do átomo, usando essas partículas alfa como sondas para examinar o interior de uma estrutura tão minúscula. Os físicos Hans Geiger e Ernest Marsden o acompanharam na tarefa..
Eles esperavam ver como uma partícula alfa, que é um átomo de hélio duplamente ionizado, interagiria com um único átomo de ouro, para garantir que qualquer desvio que experimentasse fosse devido exclusivamente à força elétrica..
No entanto, a maioria das partículas alfa passou pela folha de ouro com apenas um ligeiro desvio..
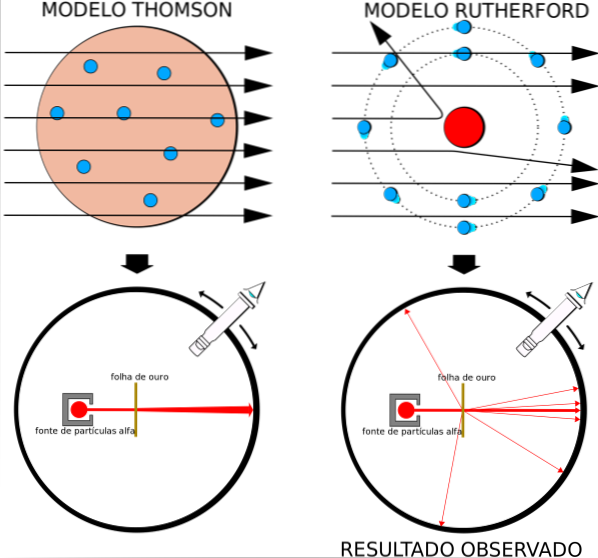
Esse fato estava em total concordância com o modelo atômico de Thomson, porém, para surpresa dos pesquisadores, uma pequena porcentagem das partículas alfa experimentou um desvio bastante notável..
E uma porcentagem ainda menor de partículas voltaria, saltando completamente de volta. Quais foram esses resultados inesperados devido a?
Índice do artigo
- 1 Descrição e conclusões do experimento
- 1.1 Conclusões
- 2 Influências no modelo do átomo
- 2.1 Desvantagens do modelo Rutherford
- 2.2 O próton e o nêutron
- 3 Como é um modelo em escala do átomo de hidrogênio?
- 4 O modelo atômico hoje
- 5 referências
Descrição e conclusões do experimento
Na verdade, as partículas alfa que Rutherford usava como sonda são núcleos de hélio, e naquela época só se sabia que essas partículas tinham carga positiva. Hoje se sabe que as partículas alfa são compostas por dois prótons e dois nêutrons..
Partículas alfa e partículas beta foram identificadas por Rutherford como dois tipos diferentes de radiação de urânio. As partículas alfa, muito mais massivas do que o elétron, têm uma carga elétrica positiva, enquanto as partículas beta podem ser elétrons ou pósitrons..
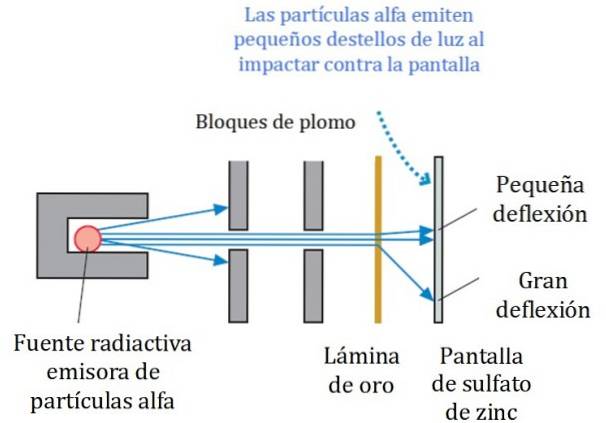
Um esquema simplificado do experimento é mostrado na Figura 2. O feixe de partículas alfa vem de uma fonte radioativa. Geiger e Marsden usaram gás radônio como emissor.
Os blocos de chumbo foram usados para direcionar a radiação para a folha de ouro e evitar que ela fosse diretamente para a tela fluorescente. O chumbo é um material que absorve radiação.
O feixe assim direcionado foi então feito para incidir em uma fina folha de ouro e a maioria das partículas continuaram em seu caminho para a tela fluorescente de sulfato de zinco, onde deixaram um pequeno traço de luz. Geiger ficou encarregado de contá-los um por um, embora mais tarde eles tenham projetado um dispositivo que fez.
O fato de que algumas partículas sofreram uma pequena deflexão não surpreendeu Rutherford, Geiger e Marsden. Afinal, existem cargas positivas e negativas no átomo que exercem forças sobre as partículas alfa, mas como o átomo é neutro, o que eles já sabiam, os desvios deveriam ser pequenos..
A surpresa do experimento é que algumas partículas positivas foram devolvidas quase diretamente..
Conclusões
Cerca de 1 em 8.000 partículas alfa foram desviadas em ângulos maiores que 90º. Poucos, mas o suficiente para questionar algumas coisas.
O modelo atômico em voga era o de pudim de passas de Thomson, o ex-professor de Rutherford no Laboratório Cavendish, mas Rutherford se perguntou se a ideia de um átomo sem núcleo e com elétrons embutidos como passas estava correta..
Porque acontece que essas grandes deflexões de partículas alfa, e o fato de que algumas são capazes de retornar, só podem ser explicadas se um átomo tiver um núcleo pequeno, pesado e positivo. Rutherford presumiu que apenas as forças elétricas de atração e repulsão, conforme indicado pela lei de Coulomb, eram responsáveis por qualquer desvio..
Quando algumas das partículas alfa se aproximam diretamente desse núcleo e como a força elétrica varia com o inverso do quadrado da distância, elas sentem uma repulsão que causa o espalhamento em grande angular ou a deflexão para trás..
Para ter certeza, Geiger e Marsden fizeram experiências bombardeando folhas de diferentes metais, não apenas ouro, embora este metal fosse o mais apropriado por sua maleabilidade, para criar folhas muito finas..
Ao obter resultados semelhantes, Rutherford estava convencido de que a carga positiva no átomo deveria estar localizada no núcleo, e não dispersa por todo o seu volume, como Thomson postulou em seu modelo..
Por outro lado, como a grande maioria das partículas alfa passou sem desvio, o núcleo tinha que ser muito, muito pequeno em comparação com o tamanho atômico. No entanto, este núcleo teve que concentrar a maior parte da massa do átomo.
Influências no modelo do átomo
Os resultados surpreenderam Rutherford, que declarou em uma conferência em Cambridge: “… É como quando você atira uma bala de canhão de 15 polegadas em uma folha de papel de seda e o projétil salta diretamente em você e o atinge.".
Como esses resultados não puderam ser explicados pelo modelo atômico de Thomson, Rutherford propôs que o átomo era composto por um núcleo, muito pequeno, muito massivo e com carga positiva. Os elétrons permaneceram em órbitas ao seu redor, como um sistema solar em miniatura.
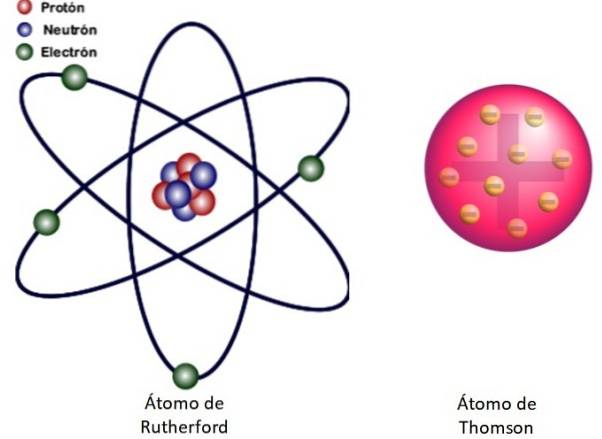
É disso que trata o modelo nuclear do átomo mostrado na Figura 3 à esquerda. Como os elétrons também são muito, muito pequenos, o átomo é quase tudo. vazio! Portanto, a maioria das partículas alfa passam pela folha mal defletida..
E a analogia com um sistema solar em miniatura é muito precisa. O núcleo atômico desempenha o papel do Sol, contendo quase toda a massa mais a carga positiva. Os elétrons orbitam ao redor deles como planetas e carregam uma carga negativa. O conjunto é eletricamente neutro.
Sobre a distribuição de elétrons no átomo, o experimento de Rutherford não mostrou nada. Você pode pensar que as partículas alfa teriam alguma interação com eles, mas a massa dos elétrons é muito pequena e eles não foram capazes de desviar significativamente as partículas..
Desvantagens do modelo Rutherford
Um problema com este modelo atômico era precisamente o comportamento dos elétrons.
Se estes não fossem estáticos, mas orbitando o núcleo atômico em órbitas circulares ou elípticas, dirigidos por atração elétrica, acabariam caindo em direção ao núcleo..
Isso porque os elétrons acelerados perdem energia e, se isso acontecer, será o colapso do átomo e da matéria..
Felizmente, não é isso que acontece. Existe uma espécie de estabilidade dinâmica que evita o colapso. O próximo modelo atômico, após o de Rutherford, foi o de Bohr, que deu algumas respostas sobre por que o colapso atômico não ocorre.
O próton e o nêutron
Rutherford continuou a fazer experimentos de espalhamento. Entre 1917 e 1918, ele e seu assistente William Kay escolheram bombardear átomos de nitrogênio gasoso com partículas alfa altamente energéticas do bismuto-214..
Ele ficou surpreso novamente, quando detectou núcleos de hidrogênio. Esta é a equação da reação, a primeira transmutação nuclear artificial já alcançada:
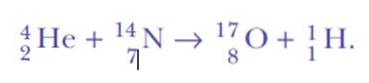
A resposta foi: do mesmo nitrogênio. Rutherford atribuiu ao hidrogênio o número atômico 1, porque é o elemento mais simples de todos: um núcleo positivo e um elétron negativo.
Rutherford encontrou uma partícula fundamental que chamou próton, um nome derivado da palavra grega para Primeiro. Dessa forma, o próton é um constituinte essencial de todo núcleo atômico..
Mais tarde, por volta de 1920, Rutherford propôs que deveria haver uma partícula neutra com uma massa muito semelhante à do próton. Ele chamou esta partícula nêutron e faz parte de quase todos os átomos conhecidos. O físico James Chadwick finalmente o identificou em 1932.
Como é um modelo em escala do átomo de hidrogênio?
O átomo de hidrogênio é, como dissemos, o mais simples de todos. No entanto, não foi fácil desenvolver um modelo para este átomo..
Descobertas sucessivas deram origem à Física Quântica e a toda uma teoria que descreve fenômenos em escala atômica. Durante esse processo, o modelo atômico também evoluiu. Mas vamos dar uma olhada na questão dos tamanhos:
O átomo de hidrogênio tem um núcleo composto por um próton (positivo) e tem um único elétron (negativo).
O raio do átomo de hidrogênio foi estimado em 2,1 x 10-10 m, enquanto o do próton é 0,85 x 10 -quinze m ou 0,85 femtômetros. O nome desta pequena unidade deve-se a Enrico Fermi e é muito usado quando se trabalha nesta escala.
Bem, o quociente entre o raio do átomo e o do núcleo é da ordem de 105 m, isto é, o átomo é 100.000 vezes maior que o núcleo!!.
Porém, deve-se levar em consideração que no modelo contemporâneo, baseado na Mecânica Quântica, o elétron envolve o núcleo em uma espécie de nuvem chamada orbital (um orbital não é uma órbita) e o elétron, na escala atômica, não é pontual.
Se o átomo de hidrogênio fosse aumentado - imaginativamente - para o tamanho de um campo de futebol, então o núcleo composto por um próton positivo seria do tamanho de uma formiga no centro do campo, enquanto o elétron negativo seria como uma espécie de fantasma , espalhado por todo o campo e em torno do núcleo positivo.
O modelo atômico hoje
Esse modelo atômico do "tipo planetário" está muito arraigado e é a imagem que a maioria das pessoas tem do átomo, pois é muito fácil de visualizar. Porém, não é o modelo hoje aceito no campo científico.
Os modelos atômicos contemporâneos são baseados na Mecânica Quântica. Ela ressalta que o elétron no átomo não é um ponto com carga negativa que segue órbitas precisas, como as que Rutherford imaginou..
Em vez disso, o elétron é espalhado em zonas, em torno do núcleo positivo, chamado orbitais atômicos. Dele podemos saber probabilidade estar em um estado ou outro.
Apesar disso, o modelo de Rutherford representou um enorme avanço na compreensão da estrutura interna do átomo. E abriu caminho para que mais pesquisadores continuem a refiná-lo..
Referências
- Andriessen, M. 2001. Curso HSC. Física 2. Jacaranda HSC Science.
- Arfken, G. 1984. University Physics. Academic Press.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Physics OpenLab. O Experimento Rutherford-Geiger-Marsden. Recuperado de: physicsopenlab.org.
- Rex, A. 2011. Fundamentos de Física. Pearson.
- Tyson, T. 2013. The Rutherford Scattering Experiment. Obtido em: 122.physics.ucdavis.edu.
- Xaktly. Experimentos de Rutherford. Recuperado de: xaktly.com.
- Wikipedia. Experiência de Rutherford. Recuperado de: es.wikipedia.org.



Ainda sem comentários