
Características e exemplos da ligação covalente polar

UMA ligação covalente polar É aquele formado entre dois elementos químicos cuja diferença de eletronegatividade é substancial, mas sem se aproximar de um caráter puramente iônico. É, portanto, uma forte interação intermediária entre as ligações covalentes apolares e as ligações iônicas..
Diz-se que é covalente porque, em teoria, há um compartilhamento igual de um par eletrônico entre os dois átomos ligados; ou seja, os dois elétrons são compartilhados igualmente. O átomo E doa um elétron, enquanto X contribui com o segundo elétron para formar a ligação covalente E: X ou E-X.
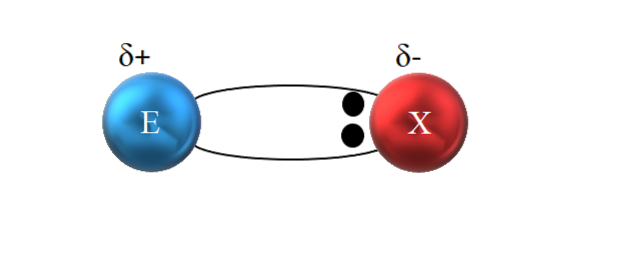
Porém, como visto na imagem acima, os dois elétrons não estão localizados no centro de E e X, indicando que eles "circulam" com a mesma frequência entre os dois átomos; em vez disso, eles estão mais próximos de X do que de E. Isso significa que X atraiu o par de elétrons para si devido à sua maior eletronegatividade.
Como os elétrons da ligação estão mais próximos de X do que de E, em torno de X é criada uma região de alta densidade eletrônica, δ-; enquanto em E aparece uma região pobre em elétrons, δ +. Portanto, há uma polarização das cargas elétricas: uma ligação covalente polar.
Índice do artigo
- 1 recursos
- 1.1 Graus de polaridade
- 1.2 Elementos químicos que os originam
- 1.3 Caráter polar e iônico
- 2 Exemplos de ligação covalente polar
- 2.1 C-O
- 2,2 H-X
- 2,3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 referências
Caracteristicas
Graus de polaridade
As ligações covalentes são muito abundantes na natureza. Eles estão presentes em praticamente todas as moléculas heterogêneas e compostos químicos; já que, no final, é formado quando dois átomos diferentes E e X se ligam. No entanto, existem ligações covalentes mais polares que outras, e para descobrir, deve-se recorrer a eletronegatividades.
Quanto mais eletronegativo X for e menos eletronegativo E (eletropositivo), a ligação covalente resultante será mais polar. A forma convencional de estimar essa polaridade é por meio da fórmula:
χX - χE
Onde χ é a eletronegatividade de cada átomo de acordo com a escala de Pauling.
Se esta subtração ou subtração tiver valores entre 0,5 e 2, então será uma ligação polar. Portanto, é possível comparar o grau de polaridade entre vários links E-X. Caso o valor obtido seja superior a 2, falamos de uma ligação iônica, E+X- E não éδ+-Xδ-.
No entanto, a polaridade da ligação E-X não é absoluta, mas depende do ambiente molecular; ou seja, em uma molécula -E-X-, onde E e X formam ligações covalentes com outros átomos, os últimos influenciam diretamente o referido grau de polaridade.
Elementos químicos que os originam
Embora E e X possam ser qualquer elemento, nem todos eles causam ligações covalentes polares. Por exemplo, se E é um metal altamente eletropositivo, como os alcalinos (Li, Na, K, Rb e Cs), e X é um halogênio (F, Cl, Br e I), eles tendem a formar compostos iônicos (N / D+Cl-) e nenhuma molécula (Na-Cl).
É por isso que ligações covalentes polares são normalmente encontradas entre dois elementos não metálicos; e, em menor grau, entre elementos não metálicos e alguns metais de transição. Assistindo o bloco p da tabela periódica, você tem muitas opções para formar esses tipos de ligações químicas.
Caráter polar e iônico
Em moléculas grandes, não é muito importante pensar sobre o quão polar é uma ligação; Estes são altamente covalentes, e a distribuição de suas cargas elétricas (onde estão as regiões ricas ou pobres de elétrons) chama mais atenção do que definir o grau de covalência de suas ligações internas..
No entanto, com moléculas diatômicas ou pequenas, a polaridade Eδ+-Xδ- é bastante relativo.
Este não é um problema com moléculas formadas entre elementos não metálicos; Mas quando metais de transição ou metalóides participam, não falamos mais apenas de uma ligação covalente polar, mas de uma ligação covalente com um certo caráter iônico; e no caso de metais de transição, de uma ligação de coordenação covalente dada a sua natureza.
Exemplos de ligação covalente polar
CO
A ligação covalente entre carbono e oxigênio é polar, porque a primeira é menos eletronegativa (χC = 2,55) do que o segundo (χOU = 3,44). Portanto, quando vemos as ligações C-O, C = O ou C-O-, saberemos que são ligações polares.
H-X
Halogenetos de hidrogênio, HX, são exemplos ideais para entender a ligação polar em suas moléculas diatômicas. Ter a eletronegatividade do hidrogênio (χH = 2,2), podemos estimar o quão polares esses haletos são entre si:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBr (H-Br), χBr (2,96) - χH (2,2) = 0,76
-HI (H-I), χeu (2,66) - χH (2,2) = 0,46
Observe que, de acordo com esses cálculos, a ligação H-F é a mais polar de todas. Agora, qual é o seu caráter iônico expresso em porcentagem, é outra questão. Esse resultado não é surpreendente porque o flúor é o elemento mais eletronegativo de todos..
À medida que a eletronegatividade cai do cloro para o iodo, as ligações H-Cl, H-Br e H-I também se tornam menos polares. A ligação H-I deve ser apolar, mas na verdade é polar e também muito "frágil"; quebra facilmente.
OH
A ligação polar O-H é talvez a mais importante de todas: graças a ela existe vida, pois colabora com o momento dipolar da água. Se estimarmos a diferença entre as eletronegatividades do oxigênio e dos hidrogênios teremos:
χOU (3,44) - χH (2,2) = 1,24
No entanto, a molécula de água, HdoisOu, você tem duas dessas ligações, H-O-H. Isso, junto com a geometria angular da molécula e sua assimetria, torna-a um composto altamente polar..
N-H
A ligação N-H está presente nos grupos amino das proteínas. Repetindo o mesmo cálculo, temos:
χN (3,04) - χH (2,2) = 0,84
Isso reflete que a ligação N-H é menos polar do que O-H (1.24) e F-H (1.78).
Feio
A ligação Fe-O é importante porque seus óxidos são encontrados em minerais de ferro. Vamos ver se é mais polar do que H-O:
χOU (3,44) - χFé (1,83) = 1,61
Portanto, é corretamente assumido que a ligação Fe-O é mais polar do que a ligação H-O (1.24); ou o que é o mesmo que dizer: Fe-O tem um caráter iônico maior do que H-O.
Esses cálculos são usados para descobrir os graus de polaridade entre vários links; mas não são suficientes para determinar se um composto é iônico, covalente ou seu caráter iônico.
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Laura Nappi. (2019). Ligações covalentes polares e não polares: definições e exemplos. Estudar. Recuperado de: study.com
- Helmenstine, Anne Marie, Ph.D. (18 de setembro de 2019). Definição e exemplos de ligação polar (ligação covalente polar). Recuperado de: Thoughtco.com
- Elsevier B.V. (2019). Polar Covalent Bond. ScienceDirect. Recuperado de: sciencedirect.com
- Wikipedia. (2019). Polaridade química. Recuperado de: en.wikipedia.org
- Anônimo. (5 de junho de 2019). Propriedades das ligações covalentes polares. Chemistry LibreTexts. Recuperado de: chem.libretexts.org



Ainda sem comentários