
Partes da célula eletrolítica, como funciona e aplicações
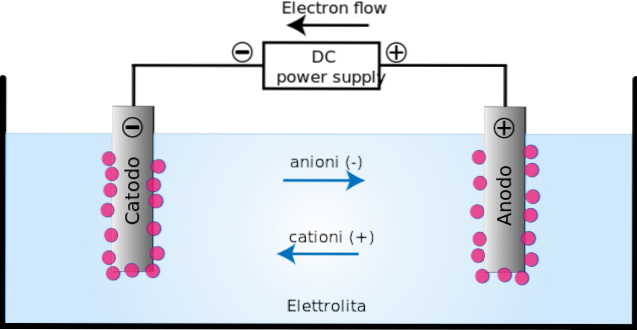
O célula eletrolítica é um meio em que a energia ou uma corrente elétrica é usada para realizar uma reação de redução de óxido não espontânea. Consiste em dois eletrodos: o ânodo e o cátodo.
No ânodo (+) ocorre oxidação, pois neste local alguns elementos ou compostos perdem elétrons; enquanto no cátodo (-), a redução, já que nele alguns elementos ou compostos ganham elétrons.
Na célula eletrolítica, a decomposição de algumas substâncias, antes ionizadas, ocorre por meio de um processo conhecido como eletrólise..
A aplicação da corrente elétrica produz uma orientação no movimento dos íons na célula eletrolítica. Íons carregados positivamente (cátions) migram em direção ao cátodo de carga (-).
Enquanto isso, os íons carregados negativamente (ânions) migram em direção ao ânodo carregado (+). Esta transferência de carga constitui uma corrente elétrica (imagem superior). Nesse caso, a corrente elétrica é conduzida por soluções eletrolíticas, presentes no recipiente da célula eletrolítica..
A Lei da eletrólise de Faraday afirma que a quantidade de substância que sofre oxidação ou redução em cada eletrodo é diretamente proporcional à quantidade de eletricidade que passa pela célula ou célula..
Índice do artigo
- 1 partes
- 2 Como funciona uma célula eletrolítica?
- 2.1 Eletrólise de cloreto de sódio fundido
- 2.2 Down Cell
- 3 aplicativos
- 3.1 Sínteses industriais
- 3.2 Revestimento e refino de metais
- 4 referências
Peças
Uma célula eletrolítica é composta por um recipiente onde é depositado o material que sofrerá as reações induzidas pela carga elétrica..
O recipiente possui um par de eletrodos que são conectados a uma bateria de corrente contínua. Os eletrodos normalmente utilizados são de material inerte, ou seja, não participam das reações..
Um amperímetro pode ser conectado em série com a bateria para medir a intensidade da corrente que flui através da solução eletrolítica. Da mesma forma, um voltímetro é colocado em paralelo para medir a diferença de tensão entre o par de eletrodos..
Como funciona uma célula eletrolítica?
Eletrólise de cloreto de sódio fundido
É preferível usar cloreto de sódio fundido em vez de cloreto de sódio sólido, uma vez que este último não conduz eletricidade. Íons vibram dentro de seus cristais, mas eles não são livres para se mover.
Reação catódica
Eletrodos feitos de grafite, um material inerte, são conectados aos terminais da bateria. Um eletrodo é conectado ao terminal positivo da bateria, constituindo o ânodo (+).
Enquanto isso, o outro eletrodo é conectado ao terminal negativo da bateria, constituindo o cátodo (-). Quando a corrente flui da bateria, o seguinte é observado:
No cátodo (-) há uma redução do íon Na+, que ao ganhar um elétron são transformados em Na metálico:
N / D+ + e- => Na (l)
Sódio metálico branco prateado flutua em cima de cloreto de sódio fundido.
Reação do ânodo
Pelo contrário, a oxidação do íon Cl ocorre no ânodo (+)-, uma vez que ele perde elétrons e se torna cloro gasoso (Cldois), um processo que se manifesta pelo aparecimento no ânodo de um gás verde pálido. A reação que ocorre no ânodo pode ser descrita da seguinte forma:
2Cl- => Cldois (g) + 2 e-
A formação de gás Na e Cl metálicosdois do NaCl não é um processo espontâneo, necessitando de temperaturas superiores a 800º C para ocorrer. A corrente elétrica fornece a energia para que a transformação indicada ocorra nos eletrodos da célula eletrolítica..
Os elétrons são consumidos no cátodo (-) no processo de redução e são produzidos no ânodo (+) durante a oxidação. Portanto, os elétrons fluem através do circuito externo da célula eletrolítica do ânodo para o cátodo..
A bateria de corrente contínua fornece a energia para que os elétrons fluam de forma não espontânea do ânodo (+) para o cátodo (-).
Down Cell
A célula Down é uma adaptação da célula eletrolítica descrita e utilizada para a produção industrial de Na metálico e gás cloro..
A célula eletrolítica de Down possui dispositivos que permitem a coleta, separadamente, do sódio metálico e do gás cloro. Este método de produção de sódio metálico ainda é muito prático.
Uma vez liberado pela eletrólise, o sódio metálico líquido é drenado, resfriado e cortado em blocos. Posteriormente, é armazenado em meio inerte, pois o sódio pode reagir de forma explosiva ao contato com a água ou com o oxigênio atmosférico..
O cloro gasoso é produzido na indústria, principalmente, pela eletrólise do cloreto de sódio em um processo menos caro do que a produção do sódio metálico..
Formulários
Sínteses Industriais
-Na indústria, as células eletrolíticas são usadas na eletrorrefinação e galvanoplastia de vários metais não ferrosos. Quase todo o alumínio, cobre, zinco e chumbo de alta pureza são produzidos industrialmente em células eletrolíticas..
-O hidrogênio é produzido pela eletrólise da água. Este procedimento químico também é usado na obtenção de água pesada (DdoisOU).
-Metais como Na, K e Mg são obtidos pela eletrólise de eletrólitos fundidos. Além disso, não metais como fluoretos e cloretos são obtidos por eletrólise. Além disso, compostos como NaOH, KOH, NadoisCO3 e KMnO4 são sintetizados pelo mesmo procedimento.
Revestimento e refino de metais
-O processo de revestimento de um metal inferior com um metal de qualidade superior é conhecido como galvanoplastia. O objetivo é evitar a corrosão do metal inferior e torná-lo mais atraente. Células eletrolíticas são usadas em galvanoplastia para essa finalidade..
-Metais impuros podem ser refinados por eletrólise. No caso do cobre, folhas muito finas de metal são colocadas no cátodo e grandes hastes de cobre impuro para serem refinadas no ânodo.
-O uso de itens folheados é comum na sociedade. As joias e talheres são geralmente banhados a prata; o ouro é eletrodepositado em joias e contatos elétricos. Muitos objetos são cobertos com cobre para fins decorativos.
-Os carros têm pára-lamas de aço cromado e outras peças. O cromagem de um pára-choque de carro leva apenas 3 segundos para produzir uma superfície brilhante de 0,0002 mm de espessura.
-A eletrodeposição rápida de metal produz superfícies ásperas e pretas. A eletrodeposição lenta produz superfícies lisas. As "latas" são feitas de aço revestido com estanho por eletrólise. Às vezes, essas latas são cromadas em uma fração de segundo com a espessura da camada de cromo extremamente fina.
Referências
- Whitten, Davis, Peck & Stanley. Química. (8ª ed.). CENGAGE Learning.
- eMedical Prep. (2018). Aplicações da eletrólise. Recuperado de: emedicalprep.com
- Wikipedia. (2018). Célula eletrolítica. Recuperado de: en.wikipedia.org
- Prof. Shapley P. (2012). Células galvânicas e eletrolíticas. Recuperado de: butane.chem.uiuc.edu
- Bodner Research Web. (s.f.). Células eletrolíticas. Recuperado de: chemed.chem.purdue.edu

Ainda sem comentários