
Estrutura, usos, propriedades do cloreto ferroso (FeCl2)

O cloreto ferroso é um sólido inorgânico formado pela união de um cátion Fedois+ e dois ânions cloreto Cl-. Sua fórmula química é FeCldois. Tende a absorver água do meio ambiente. Um de seus hidratos é FeCl tetra-hidratadodois•4hdoisOu que é um sólido esverdeado.
Deve-se notar que é muito solúvel em água e tende a oxidar facilmente na presença de ar, formando cloreto férrico FeCl.3. Por ser facilmente oxidável e, portanto, capaz de atuar como agente redutor, é amplamente utilizado em laboratórios de pesquisa química e biológica..

O cloreto ferroso tem vários usos, o mais importante deles é ajudar outros agentes na oxidação de lamas derivadas de águas residuais ou tratamento de esgotos. Também é utilizado no processo de revestimento de metais com ferro e tem algumas aplicações na indústria farmacêutica..
O uso de FeCl também foi experimentadodois na recuperação de metais valiosos de catalisadores usados encontrados nos escapes de veículos movidos a gasolina ou diesel.
É utilizado na indústria têxtil para fixar as cores em alguns tipos de tecidos.
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3.5 Peso específico
- 3.6 Solubilidade
- 3.7 Outras propriedades
- 4 Obtendo
- 5 usos
- 5.1 Na coloração de tecidos
- 5.2 No tratamento de águas residuais
- 5.3 Em estudos químicos
- 5.4 Em estudos bioquímicos
- 6 referências
Estrutura
Cloreto ferroso é composto de um íon ferroso Fedois+ e dois íons cloreto Cl- unido por ligações iônicas.
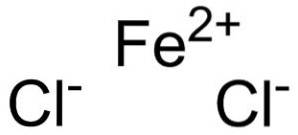
Íon ferroso Fedois+ possui a seguinte estrutura eletrônica:
1sdois, 2sdois 2 P6, 3sdois 3p6 3d6, 4s0
onde pode ser visto que ele perdeu dois elétrons da camada 4s.
Essa configuração não é muito estável, e por isso tende a se oxidar, ou seja, a perder outro elétron, desta vez da camada 3d, formando o íon Fe.3+.
Por sua vez, o íon cloreto Cl- possui a seguinte estrutura eletrônica:
1sdois, 2sdois 2 P6, 3sdois 3p6
onde você pode ver que adquiriu um elétron extra na camada 3p, completando-o. Esta configuração é muito estável porque todas as camadas eletrônicas estão completas.
Nomenclatura
- Cloreto ferroso
- Cloreto de ferro (II)
- Dicloreto de ferro
- Tetra-hidrato de cloreto ferroso: FeCldois•4hdoisOU
Propriedades
Estado físico
Sólido incolor a verde pálido, cristais.
Peso molecular
126,75 g / mol
Ponto de fusão
674 ºC
Ponto de ebulição
1023 ºC
Peso específico
3,16 a 25 ºC / 4 ºC
Solubilidade
Muito solúvel em água: 62,5 g / 100 mL a 20 ºC. Solúvel em álcool, acetona. Ligeiramente solúvel em benzeno. Praticamente insolúvel em éter.
Outras propriedades
FeCldois anidro é muito higroscópico. Absorve água facilmente do meio ambiente, formando uma variedade de hidratos, principalmente o tetrahidrato, no qual para cada molécula de FeCldois existem 4 moléculas de HdoisOu anexado a este (FeCldois•4hdoisOU).
Na presença de ar, ele oxida lentamente em FeCl3. Isso significa que o íon Fedois+ facilmente oxidado a íon Fe3+.
Se aquecido na presença de ar rapidamente forma cloreto férrico FeCl3 e óxido férrico FedoisOU3.
FeCldois é corrosivo para metais e tecidos.
Obtendo
É obtido tratando um excesso de ferro metálico Fe com uma solução aquosa de ácido clorídrico HCl a altas temperaturas..
Fé0 + 2 HCl → FeCldois + 2 h+
Porém, devido à presença de água por este método, obtém-se o cloreto ferroso tetrahidratado FeCl.dois•4hdoisOU.
Para obtê-lo anidro (sem água incorporada nos cristais), alguns pesquisadores optaram por realizar a reação do pó de ferro com HCl anidro (sem água) no solvente tetrahidrofurano (THF) a uma temperatura de 5 ºC..
O composto FeCl é obtido desta formadois•1,5THF, que quando aquecido a 80-85 ºC sob vácuo ou em atmosfera de nitrogênio (para evitar a presença de água) produz FeCldois anidro.
Formulários
O cloreto ferroso tem vários usos, geralmente baseados em sua capacidade redutora, ou seja, pode ser facilmente oxidado. É utilizado, por exemplo, em tintas e revestimentos, pois ajuda a fixá-los à superfície.
O ferro é um micronutriente essencial para a saúde humana e de alguns animais. Está envolvido na síntese de proteínas, na respiração e na multiplicação das células.
Daí o FeCldois é usado em preparações farmacêuticas. O íon Fedois+ como tal, é melhor absorvido do que o íon Fe3+ no intestino.
É usado para a fabricação de FeCl3. É utilizado na metalurgia, em banhos de revestimento de ferro, para proporcionar um depósito mais dúctil.
Aqui estão outros usos em destaque.
Na coloração de tecidos
FeCldois É usado como mordente ou fixador de tintura em alguns tipos de tecido. O mordente reage quimicamente e se liga simultaneamente ao corante e ao tecido, formando um composto insolúvel..
Dessa forma, a tinta fica fixada ao tecido e sua cor se intensifica..
No tratamento de águas residuais
FeCldois usado em estações de tratamento de esgoto ou águas residuais (esgoto).
Nessa aplicação, o cloreto ferroso participa da oxidação do lodo, por meio de um processo denominado oxidação de Fenton. Essa oxidação causa a quebra dos flocos de lama e permite a liberação da água que está fortemente ligada a ele..

O lodo pode então ser seco e descartado de forma ambientalmente correta. O uso de cloreto ferroso ajuda a reduzir os custos do processo.
Também foi proposto recentemente seu uso para reduzir a formação de sulfeto de hidrogênio ou sulfeto de hidrogênio nessas águas de esgoto..
Dessa forma, a corrosão produzida por esse gás e também os odores desagradáveis seriam reduzidos..
Em estudos químicos
Devido às suas propriedades redutoras (o oposto do oxidante), FeCldois É amplamente utilizado em várias investigações em laboratórios de química, física e engenharia.
Certos cientistas usaram vapores de cloreto ferroso para extrair metais valiosos como platina, paládio e ródio de catalisadores usados em veículos movidos a gasolina ou diesel..
Esses catalisadores são usados para remover gases prejudiciais ao homem e ao meio ambiente. Eles estão localizados no escapamento de carros e caminhões que funcionam com gasolina ou diesel.

Após um certo tempo, o conversor catalítico do veículo se desgasta e perde sua eficácia e deve ser substituído. O catalisador gasto é descartado e esforços estão em andamento para recuperar os metais valiosos que ele contém..

Segundo os pesquisadores, esses metais formaram ligas magnéticas com o ferro do cloreto ferroso..
As ligas podiam ser extraídas com ímãs e, em seguida, os metais valiosos recuperados por métodos bem conhecidos..
Em estudos bioquímicos
Por possuir a Fe caçãodois+, que é um micronutriente importante em humanos e alguns animais, FeCldois usado em estudos de bioquímica e medicina.
Certos estudos demonstraram que o cloreto ferroso melhora a eficácia fungicida do plasma de argônio frio..
Plasma frio é uma tecnologia usada para esterilizar superfícies e instrumentos médicos. Baseia-se na formação de radicais hidroxila OH · a partir da umidade do ambiente. Esses radicais reagem com a parede celular do microrganismo e causam sua morte.
Nesta investigação, o FeCldois melhorou o efeito do plasma frio e acelerou a eliminação de um fungo resistente a outros métodos de desinfecção.
Alguns cientistas descobriram que o uso de FeCldois permite aumentar o rendimento nas reações de obtenção de glicose a partir do bagaço da cana.
Neste caso, sendo o Fedois+ microelemento essencial para a saúde humana, sua presença em vestígios no produto não afetaria o ser humano.
Referências
- Fukuda, S. et al. (2019). O cloreto ferroso e o sulfato ferroso melhoram a eficácia fungicida do plasma de argônio atmosférico frio em Aureobasidium pululans melanizado. J Biosci Bioeng, 2019, 128 (1): 28-32. Recuperado de ncbi.clm.nih.gov.
- Ismal, O.E. e Yildirim, L. (2019). Mordentes e biomordantes metálicos. In The Impact and Prospects of Green Chemistry for Textile Technology. Capítulo 3, pp. 57-82. Recuperado de sciencedirect.com.
- Zhang, W. et al. (2019). Co-catálise de cloreto de magnésio e cloreto ferroso para xilo-oligossacarídeos e produção de glicose do bagaço da cana-de-açúcar Bioresour Technol 2019, 291: 121839. Recuperado de ncbi.nlm.nih.gov.
- Zhou, X. et al. (2015). Papel do ferro nativo na melhoria da capacidade de desidratação do lodo por meio da peroxidação. Relatórios científicos 5: 7516. Recuperado de ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Controle de sulfeto de hidrogênio em esgotos catalisando a reação com o oxigênio. Ciência do ambiente total 689 (2019) 1192-1200. Recuperado de ncbi.nlm.nih.gov.
- Taninouchi, Y. e Okabe, T.H. (2018). Recuperação de metais do grupo da platina a partir de catalisadores gastos usando tratamento com vapor de cloreto de ferro. Metall and Materi Trans B (2018) 49: 1781. Recuperado de link.springer.com.
- NÓS. Biblioteca Nacional de Medicina. (2019). Cloreto Ferroso. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Oxidação de ferro (0) por cloreto de hidrogênio em tetrahidrofurano: uma maneira simples de obter cloreto de ferro anidro (II). Inorganic Chemistry, Vol. 16, No. 7, 1977. Recovered from pubs.acs.org.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.


Ainda sem comentários