
Fórmula do gás cloro, efeitos, usos e riscos
O gás cloro (dicloro, cloro diatômico, cloro molecular ou simplesmente cloro) é um gás amarelo-esverdeado, com odor pungente e sufocante, não combustível à temperatura ambiente e pressão atmosférica.
É o elemento com a maior afinidade eletrônica e a terceira maior eletronegatividade, atrás apenas do oxigênio e do flúor. É extremamente reativo e um forte agente oxidante.
O alto potencial de oxidação do cloro elementar levou ao desenvolvimento de alvejantes e desinfetantes comerciais, bem como um reagente para muitos processos na indústria química..
Na forma de íons cloreto, o cloro é necessário para todas as espécies de vida conhecidas. Mas o cloro elementar em altas concentrações é extremamente perigoso e venenoso para todos os organismos vivos, razão pela qual foi usado na Primeira Guerra Mundial como o primeiro agente de guerra química gasoso..

É tóxico por inalação. A inalação a longo prazo de baixas concentrações ou a inalação a curto prazo de altas concentrações de gás cloro têm efeitos prejudiciais à saúde..
Os vapores são muito mais pesados que o ar e tendem a se depositar em áreas baixas. Não queima, mas apóia a combustão. É ligeiramente solúvel em água. O contato com líquidos não confinados pode causar congelamento por resfriamento evaporativo.
Usado para purificar água, branquear polpa de madeira e fazer outros produtos químicos.
Índice do artigo
- 1 Fórmula
- 2 estrutura 2D
- 3 recursos
- 3.1 Propriedades físicas e químicas
- 3.2 Alertas de reatividade
- 3.3 Inflamabilidade
- 3.4 Reatividade
- 3,5 Toxicidade
- 4 usos
- 5 efeitos clínicos
- 6 Segurança e riscos
- 6.1 Classes de perigo GHS
- 6.2 Códigos de declaração de precaução
- 7 referências
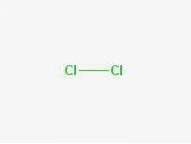
Fórmula
Fórmula: Cl-Cl
Número CAS: 7782-50-5
Estrutura 2D

Caracteristicas
Propriedades físicas e químicas

O gás cloro pertence ao grupo reativo dos agentes oxidantes fortes. Esses compostos freqüentemente reagem vigorosamente com outros compostos..
O cloro gasoso também pertence ao grupo reativo dos fortes agentes halogenantes, que transferem um ou mais átomos de halogênio para o composto com o qual estão reagindo..
Os agentes halogenantes são geralmente ácidos e, portanto, reagem, em alguns casos violentamente, com bases.
Muitos desses compostos são reativos à água e ao ar. Halogênios são oxidantes altamente eletronegativos e fortes.
Alertas de reatividade
O gás cloro é um forte agente oxidante. Reage com água. A água dissolve o gás cloro, formando uma mistura de ácido clorídrico e ácidos hipoclorosos.
Inflamabilidade
Ele pode inflamar outros materiais combustíveis (madeira, papel, óleo, etc.). A mistura com combustíveis pode causar uma explosão. O recipiente pode explodir em contato com o fogo. Há risco de explosão (e envenenamento) pelo acúmulo de seus vapores em ambientes internos, esgotos ou externos..
As misturas de hidrogênio e cloro (5-95%) podem explodir pela ação de quase qualquer forma de energia (calor, luz solar, faíscas, etc.).
Emite fumos altamente tóxicos quando aquecido. Quando combinado com água ou vapor, produz vapores de ácido clorídrico tóxicos e corrosivos.
Reatividade
O cloro reage de forma explosiva com (ou apóia a queima de) muitos materiais comuns.
- O cloro inflama o aço a 100 ° C na presença de fuligem, óxido, carbono ou outros catalisadores.
- Ligue a lã de aço seca a 50 ° C.
- Acender sulfetos em temperatura ambiente.
- Inflama (em sua forma líquida) borracha natural e sintética.
- Inflama trialquilboranos e dióxido de tungstênio.
- Inflama em contato com hidrazina, hidroxilamina e nitreto de cálcio.
- Inflama ou explode com Arsina, Fosfina, Silano, Diborano, Estibina, Fósforo Vermelho, Fósforo Branco, Boro, Carbono Ativo, Silício, Arsênico.
- Causa ignição e uma explosão suave ao borbulhar através do metanol frio.
- Explode ou incendeia se excessivamente misturado com amônia e aquecido.
- Forma tricloreto de nitrogênio explosivo em contato com o reagente de biureto contaminado com ácido cianúrico.
- Forma facilmente derivados explosivos de N-cloro com aziridina.
O cloro (em sua forma líquida ou gasosa) reage com:
- Álcoois (explosão)
- Alumínio fundido (explosão)
- Silanos (explosão)
- Pentafluoreto de bromo
- Dissulfeto de carbono (explosão catalisada por ferro)
- Cloro-2-propino (o excesso de cloro causa uma explosão)
- Dibutil Ftalato (Explosão a 118 ° C)
- Éter dietílico (lit)
- Dietil zinco (lit)
- Glicerol (explosão a 70-80 ° C)
- Metano em óxido de mercúrio amarelo (explosão)
- Acetileno (explosão iniciada por luz solar ou aquecimento)
- Etileno em mercúrio, óxido de mercúrio (I) ou óxido de prata (I) (explosão causada por calor ou luz)
- Gasolina (reação exotérmica e, em seguida, detonação)
- Mistura de nafta-hidróxido de sódio (explosão violenta)
- Cloreto de zinco (reação exotérmica)
- Cera (explosão)
- Hidrogênio (explosão iniciada pela luz)
- Carboneto de ferro
- Urânio e zircônio
- Hidretos de sódio, potássio e cobre
- Lata
- Pó de alumínio
- Pó de vanádio
- Folha de alumínio
- Ouropel
- Folha de cobre
- Pó de cálcio
- Arame de ferro
- Pó de manganês
- Potássio
- Pó de antimônio
- Bismuto
- Germânio
- Magnésio
- Sódio
- Zinco
Toxicidade
O gás cloro é venenoso e pode ser fatal se inalado. O contato pode causar queimaduras na pele e nos olhos, bem como bronquite ou doenças pulmonares crônicas..

Formulários
Aproximadamente 15.000 compostos de cloro são usados comercialmente hoje. O cloreto de sódio é de longe o composto de cloro mais comum e é a principal fonte de cloro e ácido clorídrico para a enorme indústria química de cloro..
De todo o cloro elementar produzido, aproximadamente 63% é usado na fabricação de compostos orgânicos, 18% na fabricação de compostos de cloro inorgânico e os 19% restantes do cloro produzido são usados para alvejantes e produtos de desinfecção..

Entre os compostos orgânicos mais significativos em termos de volume de produção estão 1,2-dicloroetano e cloreto de vinila (produtos intermediários na produção de PVC), cloreto de metila, cloreto de metileno, clorofórmio, cloreto de vinilideno, entre outros.
Os principais compostos inorgânicos incluem HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl3, TiCl3, , ZnCl2 e muitos mais.
O cloro gasoso é usado em operações de branqueamento industrial, tratamento de águas residuais, fabricação de comprimidos para a cloração de piscinas ou na guerra química.
O gás cloro (conhecido como bertholite), foi usado pela primeira vez como arma na Primeira Guerra Mundial pela Alemanha.
Depois do primeiro uso, os dois lados do conflito usaram o cloro como arma química, mas logo foi substituído por fosgênio e gás mostarda, que são mais letais..
O gás cloro também foi usado durante a Guerra do Iraque na província de Anbar em 2007.
Efeitos clínicos
O gás cloro é uma das exposições ocupacionais e ambientais mais comuns a irritantes por inalação única. Estudios recientes han reportado que la mezcla de blanqueador (lejía, elaborada principalmente a base de hipoclorito de sodio) con otros productos de limpieza, es la causa más frecuente (21 % de los casos) de exposición única por inhalación reportada en los centros de toxicología dos Estados Unidos.
Os principais efeitos tóxicos são devidos ao dano local ao tecido, e não à absorção sistêmica. Acredita-se que a lesão celular resulte da oxidação de grupos funcionais em componentes celulares; a reações com água nos tecidos para formar ácido hipocloroso e ácido clorídrico; e a geração de radicais livres de oxigênio (embora essa ideia seja agora controversa).
Na intoxicação leve a moderada, ocorrem: tosse, falta de ar, dor no peito, sensação de queimação na garganta e na região retroesternal, náusea ou vômito, irritação ocular e nasal, sufocação, fraqueza muscular, tontura, desconforto abdominal e dor de cabeça.
No envenenamento grave, ocorre: edema das vias aéreas superiores, laringoespasmo, edema pulmonar grave, pneumonia, hipoxemia persistente, insuficiência respiratória, lesão pulmonar aguda e acidose metabólica.
A exposição crônica ao gás cloro é uma das causas mais comuns de asma ocupacional. Pode causar dispneia, palpitações, dor torácica, síndrome de disfunção reativa das vias aéreas superiores, erosão do esmalte dentário e aumento da prevalência de síndromes virais. A exposição crônica a 15 ppm causa tosse, hemoptise, dor no peito e dor de garganta.
A exposição dérmica pode causar eritema, dor, irritação e queimaduras na pele. A exposição severa pode causar colapso cardiovascular e parada respiratória. Em altas concentrações, podem ocorrer síncope e morte quase imediata. O cloro (como hipoclorito) é teratogênico em animais experimentais.
Segurança e riscos
Declarações de perigo do Sistema Globalmente Harmonizado de classificação e rotulagem de produtos químicos (GHS).
O Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos (GHS) é um sistema acordado internacionalmente, criado pelas Nações Unidas, projetado para substituir os vários padrões de classificação e rotulagem usados em diferentes países, usando critérios consistentes em nível global (Nações Unidas, 2015 ).
As classes de perigo (e seu capítulo GHS correspondente), padrões de classificação e rotulagem e recomendações para gás cloro são as seguintes (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
Classes de perigo GHS
H270: Pode causar ou agravar incêndios; Oxidante [gases oxidantes de perigo - Categoria 1]
H280: Contém gás sob pressão; Pode explodir se aquecido [Advertência de gases sob pressão - gás comprimido, gás liquefeito, gás dissolvido]
H315: Causa irritação à pele [Advertência, corrosão / irritação cutânea - Categoria 2]
H319: Provoca irritação ocular grave [Aviso Lesões oculares graves / irritação ocular - Categoria 2A]
H330: Fatal por inalação [Toxicidade aguda de perigo, inalação - Categoria 1, 2]
H331: Tóxico por inalação [Toxicidade aguda de perigo, inalação - Categoria 3]
H335: Pode causar irritação do trato respiratório [Aviso Toxicidade para órgãos-alvo específicos, exposição única; Irritação do trato respiratório - Categoria 3]
H400: Muito tóxico para a vida aquática [Aviso Perigoso para o ambiente aquático, perigo agudo - Categoria 1]
H410: Muito tóxico para organismos aquáticos com efeitos duradouros [Aviso Perigoso para o ambiente aquático, perigo de longo prazo - Categoria 1]
(PubChem, 2017)
Códigos de declaração de precaução
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 e P501.
Referências
- Benjah-bmm27 (2007). Dicloro-gás-3D-vdW [imagem]. Recuperado de: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [imagem]. Recuperado de: commons.wikimedia.org.
- ChemIDplus (2017) Estrutura 3D de 7782-50-5 - Cloro [imagem] Recuperado de: chem.nlm.nih.gov.
- Administração Oceânica e Atmosférica Nacional (NOAA). CAMEO Chemicals. (2017). Folha de dados do grupo reativo. Agentes Oxidantes Fortes. Silver Spring, MD. EU; Recuperado de: cameochemicals.noaa.gov.
- Oelen, W., (2005). Cloro gasoso em uma garrafa [imagem]. Recuperado de: commons.wikimedia.org.
- Sargent, J., (1918). Gaseado [imagem]. Recuperado de: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [imagem]. Recuperado de: commons.wikimedia.org.
- Wikipedia (2017). Cloro. Recuperado de: en.wikipedia.org.



Ainda sem comentários