
Estrutura do ácido sulfâmico, propriedades, síntese, usos

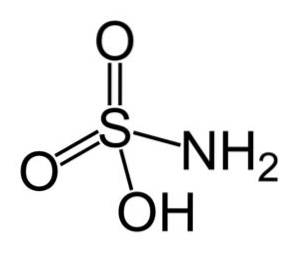
O ácido sulfâmico é um composto inorgânico formado por um átomo de enxofre (S) ligado covalentemente e por uma ligação simples a um grupo hidroxila (-OH) e a um grupo amino (-NHdois), e por ligação dupla a dois átomos de oxigênio (O). É um sólido cristalino branco. Sua fórmula química é NHdoisSW3H. Também conhecido como ácido aminossulfônico, ácido amidosulfônico, ácido amidosulfúrico e ácido sulfamídico..
O ácido sulfâmico é um ácido forte. Pode reagir com metais, óxidos metálicos e carbonatos. Seus sais são geralmente solúveis em água, tornando-o um bom removedor de incrustações em equipamentos de processo. É freqüentemente usado em usinas de açúcar para limpar incrustações de carbonato em equipamentos de evaporação..
O ácido sulfâmico é um redutor de nitrito (NOdois-) e essa propriedade química é usada em várias aplicações, como na indústria de corantes e na análise de nitritos..
É utilizado no curtimento de couro e branqueamento de celulose para fabricação de papel. Na verdade, é um contaminante alimentar, visto que costuma ser encontrado em papéis e papelão usados para embalar mantimentos..
Também é utilizado na eletrodeposição de metais, como padrão de laboratório e um de seus derivados é um herbicida muito eficaz..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3,6 pH
- 3.7 Constante de dissociação
- 3.8 Propriedades químicas
- 3.9 Outras propriedades
- 4 Síntese
- 5 usos
- 5.1 Na indústria de tinturas
- 5.2 No processamento de couro
- 5.3 No equipamento de processo de limpeza
- 5.4 No refino de metal
- 5.5 Como um reagente padrão no laboratório
- 5,6 Na análise de nitrito
- 5.7 Na análise de oxigênio dissolvido na água
- 5.8 Na preparação de óxido nitroso
- 5,9 Na agricultura
- 5.10 Em tecidos à prova de fogo
- 5.11 Em várias aplicações
- 6 referências
Estrutura
O ácido sulfâmico cristaliza na forma de cristais dipiramidais ortorrômbicos. Forma prismas compactos e folhas ao cristalizar a partir de solução fria, bem como folhas de diamante ao cristalizar a partir de solução aquosa quente.
Nomenclatura
- Ácido sulfâmico
- Ácido aminossulfônico
- Ácido amidosulfônico
- Ácido amidosulfúrico
- Ácido sulfamídico
Propriedades
Estado físico
Sólido cristalino branco.
Peso molecular
97,1 g / mol.
Ponto de fusão
205 ºC, se decompõe a 209 ºC.
Densidade
2,15 g / cm3
Solubilidade
Solúvel em água:
- 12,8% a 0 ºC
- 17,57% a 20 ºC
- 22,77% a 40 ºC
Ligeiramente solúvel em metanol, ligeiramente solúvel em acetona, insolúvel em éter.
Muito solúvel em bases nitrogenadas e em solventes orgânicos contendo nitrogênio.
Insolúvel em dissulfeto de carbono (CSdois) e tetracloreto de carbono (CCl4).
pH
0,41 (em solução 1 N, ou seja, 1 equivalente / L).
Constante de dissociação
0,101 a 25 ºC.
Propriedades quimicas
É um ácido forte. Quase tanto quanto clorídrico (HCl), nítrico (HNO3) e sulfúrico (HdoisSW4).
As soluções aquosas de ácido sulfâmico são altamente ionizadas. Seu pH é inferior ao das soluções de ácidos fórmico, fosfórico e oxálico.
Na água, o ácido sulfâmico perde apenas o próton que está ligado ao oxigênio. Os hidrogênios ligados ao nitrogênio mantêm-se fortemente unidos.
Em solução aquosa, ele hidrolisa lentamente para dar sulfato de amônio ácido (NH4HSO4) É estável em condições secas.
O ácido sulfâmico ataca metais, óxidos metálicos e carbonatos para gerar sulfamatos. Por exemplo, com o metal potássio (K) forma sulfamato de potássio (KOSOdoisNHdois) e hidrogênio (Hdois).
Todos os sais do ácido sulfâmico são solúveis em água. Os sais de cálcio, chumbo e bário são muito solúveis em água, ao contrário dos sais correspondentes do ácido sulfúrico.
Ácido nitroso (HNOdois) reage quantitativamente com o grupo amino do ácido sulfâmico, liberando nitrogênio (Ndois) Estima-se que o íon sulfamato funcione nessa reação como uma amida, não como uma amina..
O ácido sulfâmico é oxidado por cloro, bromo ou clorato de potássio para convertê-lo em ácido sulfúrico. Esta reação não ocorre com outros oxidantes, como ácido crômico ou permanganato de potássio..
Não é compatível (reage) com álcalis fortes, cloro, ácido hipocloroso, hipocloritos, cianetos e sulfetos.
Outras propriedades
Não é higroscópico (isso significa que não absorve umidade do ar).
Quando aquecido até a decomposição, emite vapores altamente tóxicos de óxidos de enxofre e cloreto de hidrogênio (HCl).
Um de seus derivados, o sulfamato de amônio, é um retardante de fogo.
É moderadamente tóxico.
Síntese
O ácido sulfâmico é obtido pela reação de ureia CO (NHdois)dois com ácido sulfúrico fumante, isto é, ácido sulfúrico (HdoisSW4) concentrado contendo trióxido de enxofre (SO3).
Também pode ser sintetizado pela reação de ácido clorossulfônico (HClO3Cl) e amônia (NH3).
Formulários
Na industria de tinturas
O ácido sulfâmico é usado para remover o excesso de nitritos de forma rápida e eficaz nas reações de diazotização na síntese de corantes. É muito mais prático do que a ureia para esse fim.
No processamento de couro
Durante o curtimento do couro, o uso de ácido sulfâmico em vez de ácido sulfúrico proporciona uma textura mais fina e sedosa.
Além disso, como o sulfamato de cálcio é solúvel em água, ao contrário do sulfato de cálcio, o ácido sulfâmico pode ser usado no processo de desbaste sem deixar manchas que às vezes ocorrem no couro com o uso do ácido sulfúrico..

No equipamento de processo de limpeza
O ácido sulfâmico é usado como um limpador descalcificante em chaleiras, reatores, tubos, sistemas de resfriamento e trocadores de calor.
Nesses equipamentos, as incrustações são formadas pela circulação de água ou compostos de processo em usinas, usinas químicas, siderúrgicas, papeleiras, estações de compressão e outras indústrias..
Os depósitos de incrustações ou sólidos podem ser orgânicos (algas, lodo, fungos) ou inorgânicos (óxidos de ferro, sulfetos de ferro, carbonatos de cálcio ou magnésio, sulfatos, fosfatos ou silicatos).
O ácido sulfâmico é muito eficaz quando usado para remover incrustações de carbonato de cálcio. Pode ser usado em equipamentos de cobre, latão, aço inoxidável, ferro fundido e aço galvanizado.
É utilizado na forma de solução de 5-10% em peso. É especialmente utilizado em usinas de açúcar para limpar evaporadores de ferro fundido com trocadores de calor de cobre.

Deve ser usado em temperaturas não superiores a 50-60 ºC. Temperaturas de 70 ºC levam à formação de sulfatos insolúveis como CaSO4.
Quando usado em combinação com cloreto de sódio, ocorre um efeito sinérgico e a solução permite que o óxido férrico se dissolva lentamente. Neste caso, não deve ser utilizado com aço inoxidável, pois há liberação de ácido clorídrico, que pode causar corrosão neste material..
No refino de metais
A galvanoplastia de metais como cobre, prata, cobalto, níquel, zinco, cádmio, ferro e chumbo pode ser realizada com sucesso em soluções de ácido sulfâmico. Isso pode ser tratado com muito mais facilidade do que o ácido fluorossilícico (HdoisSiF6).
Como um reagente padrão no laboratório
Dadas certas características do ácido sulfâmico, tais como: sua força como um ácido, sua facilidade de ser purificado por recristalização em água, sua estabilidade e sua não higroscopicidade, ele tem sido usado como um padrão primário em nível de laboratório. Isso significa que ele é usado para determinações quantitativas de álcali..

Na análise de nitrito
Devido à sua fácil reação com os nitritos, o ácido sulfâmico é usado para determiná-los em solução..
Na análise do oxigênio dissolvido na água
Como o ácido sulfâmico reage com os nitritos da água, o nitrogênio é liberado, é possível realizar a determinação do oxigênio dissolvido na água, uma vez que a interferência causada pelos nitritos é eliminada..
Na preparação de óxido nitroso
O ácido sulfâmico reage com o ácido nítrico para gerar óxido nitroso (NdoisOU). Esta reação é mais segura do que a do nitrato de amônio para obter este gás.
Na agricultura
Um derivado do ácido sulfâmico, o sulfamato de amônio, é um herbicida não tóxico eficaz para animais.
É aplicado por orvalho sobre as folhas das espécies a serem retiradas no final do verão ou início do outono, de preferência em climas úmidos. Conforme o composto se desloca das folhas às raízes, a planta morre.

Outra vantagem desse composto é que ele não esteriliza permanentemente o solo. De fato, parte do nitrogênio do sulfamato de amônio estará disponível no solo para o crescimento das plantas na próxima estação..
Em tecidos à prova de fogo
Sua compatibilidade com a celulose e suas características ignífugas fazem do sulfamato de amônio um agente para a obtenção de tecidos e papéis resistentes ao fogo..
É utilizado com 10% do peso do tecido, cuja aparência e toque permanecem inalterados. O tecido quando em uso deve ser lavado a seco, nunca lavado com água para não dissolver o sulfamato.
É especialmente útil em cortinas de teatro ou lugares semelhantes.

Em várias aplicações
É usado como catalisador em algumas reações químicas, como na preparação de resinas de uréia-formaldeído. Também é útil como bactericida e estabilizador de cloro em piscinas e como branqueador de polpa de madeira em fábricas de celulose e papel..
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Ácido sulfâmico. Recuperado de pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosação em centros de nitrogênio. In Nitrosation Reactions and the Chemistry of Nitric Oxide. Capítulo 2. Recuperado de sciencedirect.com
- Clapp, Leallyn B. (1943). Ácido sulfâmico e seus usos. Chem. Educ. 1943, 20, 4, 189. Recovered from pubs.acs.org
- McDonald, James. (2003). Ácido sulfâmico. Recuperado de veoliawatertech.com
- Sastri, V.S. (2010). Gestão e controle de corrosão. Na corrosão de Shreir. Recuperado de sciencedirect.com
- Pratima Bajpai. (2018). Tópicos diversos. No Manual de Celulose e Papel de Biermann. Terceira edição. Recuperado de sciencedirect.com


Ainda sem comentários