
Mecanismos de corrosão galvânica, exemplos, proteção
O corrosão galvânica ou eletroquímica É um processo pelo qual um metal ou liga se degrada mais rapidamente em comparação com sua oxidação convencional. Pode-se dizer que é uma oxidação acelerada, e até, propiciada intencionalmente; como acontece em células ou baterias.
Isso ocorre sob várias condições. Primeiro, deve haver um metal ativo, chamado ânodo. Além disso, e em segundo lugar, deve haver um metal nobre de baixa reatividade chamado cátodo. A terceira e a quarta condições são a presença de um meio onde os elétrons se propagam, como água e espécies iônicas ou eletrólitos..

A corrosão galvânica é observada especialmente em ambientes marinhos ou nas margens das praias. As correntes de ar aumentam as massas de vapor d'água, que por sua vez carregam alguns íons; as últimas acabam aderindo a uma fina camada de água ou gotas que repousam na superfície do metal.
Essas condições de umidade e salinidade favorecem a corrosão do metal. Ou seja, uma coroa de ferro como a da imagem acima enferruja mais rapidamente se for exposta nas proximidades do mar..
A facilidade que um metal terá de oxidar em comparação com outro pode ser medida quantitativamente por meio de seus potenciais de redução; os livros de química abundam em mesas com esses potenciais E. Quanto mais negativo, maior sua tendência à ferrugem..
Da mesma forma, se este metal estiver na presença de outro com potencial de redução muito positivo, possuindo portanto um ΔE grande, a oxidação do metal reativo será mais agressiva. Outros fatores, como pH, força iônica, umidade, presença de oxigênio e a relação entre as áreas do metal que é oxidado e aquele que é reduzido, também são importantes..
Índice do artigo
- 1 mecanismo
- 1.1 Conceitos e reações
- 1.2 Depolarizadores
- 1.3 Corrosão de ferro
- 2 exemplos
- 2.1 Índices anódicos
- 3 Proteção contra corrosão eletroquímica
- 3.1 Revestimentos Sacrificiais
- 3.2 Revestimentos nobres
- 4 Experimento para crianças
- 4.1 Placa de ferro em solução de sais de cobre
- 4.2 Limpeza de óxido de prata
- 5 referências
Mecanismos
Conceitos e reações
Antes de abordar os mecanismos por trás da corrosão galvânica, certos conceitos devem ser esclarecidos.
Em uma reação redox, uma espécie perde elétrons (oxida) enquanto outra os ganha (reduz). O eletrodo no qual ocorre a oxidação é denominado ânodo; e em que ocorre a redução, cátodo (em inglês a regra mnemônica gato vermelho lembrar).
Assim, para um eletrodo (uma peça, parafuso, etc.) de um metal M, se ele oxida, diz-se que é o ânodo:
M => Mn+ + ne-
O número de elétrons liberados será igual à magnitude da carga positiva do cátion Mn+ resultante.
Em seguida, outro eletrodo ou metal R (ambos os metais devem estar em contato de alguma forma), recebe os elétrons liberados; mas este não sofre uma reação química se ganhar elétrons, pois só os estaria conduzindo (corrente elétrica).
Portanto, deve haver outra espécie em solução que pode aceitar formalmente esses elétrons; como íons metálicos facilmente reduzidos, por exemplo:
Rn+ + ne- => R
Ou seja, uma camada de metal R se formaria e o eletrodo ficaria, portanto, mais pesado; enquanto o metal M perderia massa devido à dissolução de seus átomos.
Despolarizadores
E se não houvesse cátions metálicos que pudessem ser reduzidos com bastante facilidade? Nesse caso, outras espécies presentes no meio levarão os elétrons: os despolarizadores. Eles estão intimamente relacionados ao pH: Odois, H+, Oh- e HdoisOU.
O oxigênio e a água ganham elétrons em uma reação expressa pela seguinte equação química:
OUdois + 2hdoisO + 4e- => 4OH-
Enquanto os íons H+ transformar em Hdois:
2h+ + 2e- => Hdois
Ou seja, a espécie OH- e Hdois são produtos comuns de corrosão galvânica ou eletroquímica.
Mesmo que o metal R não participe de nenhuma reação, o fato de ser mais nobre que M promove sua oxidação; e, consequentemente, haverá uma maior produção de íons OH- ou gás hidrogênio. Porque, afinal, é a diferença entre os potenciais de redução, ΔE, um dos principais motores desses processos.
Corrosão do ferro
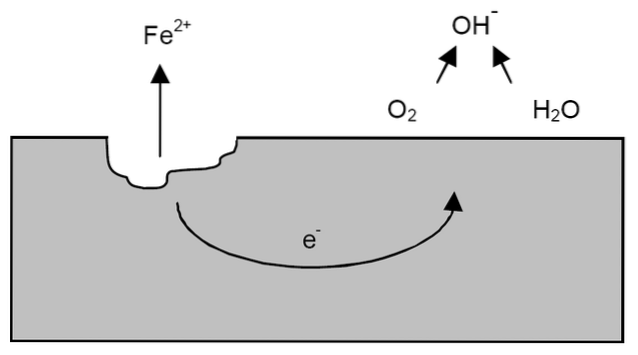
Após os esclarecimentos anteriores, pode-se abordar o exemplo da corrosão do ferro (imagem superior). Suponha que haja uma fina camada de água na qual o oxigênio se dissolva. Sem a presença de outros metais, serão os despolarizadores que definirão as diretrizes para a reação.
Assim, o ferro perderá alguns átomos de sua superfície para se dissolver na água como cátions de ferro.dois+:
Fé => Fédois+ + 2e-
Os dois elétrons viajarão através do pedaço de ferro porque é um bom condutor de eletricidade. Portanto, sabe-se onde a oxidação ou o local do ânodo começou; mas não onde a redução ocorrerá ou a localização do sítio catódico. O local do cátodo pode estar em qualquer lugar; e quanto maior sua área possível, pior o metal irá corroer.
Suponha que os elétrons atinjam um ponto conforme mostrado na imagem acima. Lá, tanto o oxigênio quanto a água sofrem a reação já descrita, pela qual o OH é liberado-. Estes ânions OH- pode reagir com o Fedois+ para formar Fe (OH)dois, que precipita e sofre oxidações subsequentes que finalmente o transformam em ferrugem.
Enquanto isso, o ânodo está rachando cada vez mais.
Exemplos
Na vida cotidiana, os exemplos de corrosão galvânica são numerosos. Não precisamos nos referir à coroa de ferro: qualquer artefato feito de metais pode sofrer o mesmo processo na presença de ambientes úmidos e salgados..
Além da praia, o inverno também pode oferecer condições ideais para a corrosão; por exemplo, ao despejar sais na neve na estrada para evitar que os carros derrapem.
Do ponto de vista físico, a umidade pode ser retida nas juntas soldadas de dois metais, sendo sítios ativos de corrosão. Isso ocorre porque os dois metais se comportam como dois eletrodos, e o mais reativo perderá seus elétrons..
Se a produção de íons OH- É considerável, pode até corroer a pintura do carro ou do dispositivo em questão.
Índices anódicos
Pode-se construir seus próprios exemplos de corrosão galvânica utilizando as tabelas de potencial de redução. No entanto, a tabela de índice anódico (simplificada em si mesma) será escolhida para ilustrar este ponto..
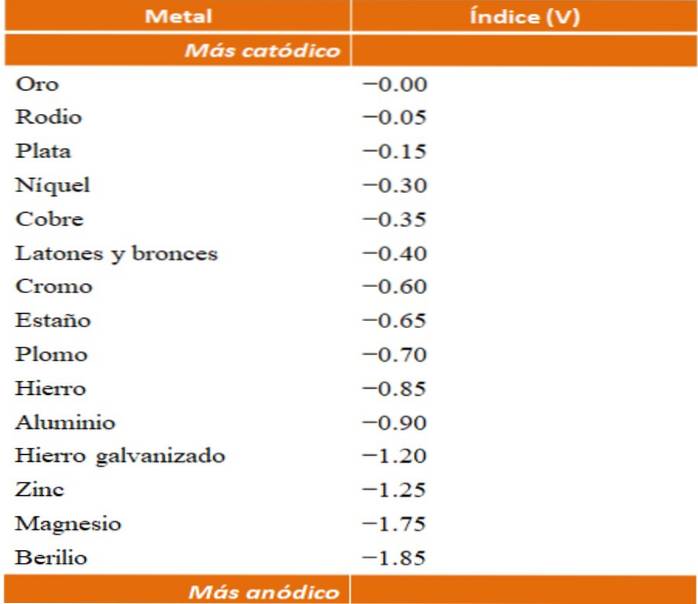
Suponha, por exemplo, que queremos construir uma célula eletroquímica. Os metais que estão no topo da tabela de índice anódico são mais catódicos; isto é, eles são facilmente reduzidos e, portanto, será difícil tê-los em solução. Enquanto os metais que estão na parte inferior são mais anódicos ou reativos e corroem facilmente.
Se escolhermos ouro e berílio, os dois metais não poderiam ficar juntos por muito tempo, pois o berílio se oxidaria com extrema rapidez..
E se, por outro lado, tivermos uma solução de íons Ag+ e se imergirmos nela uma barra de alumínio, esta se dissolverá ao mesmo tempo que precipitam as partículas de prata metálica. Se essa barra fosse conectada a um eletrodo de grafite, os elétrons viajariam até ela para depositar prata eletroquimicamente nela como um filme de prata..
E se em vez da barra de alumínio ela fosse de cobre, a solução ficaria azulada devido à presença de íons Cu.dois+ na água.
Proteção contra corrosão eletroquímica
Revestimentos de sacrifício
Suponha que você queira proteger uma folha de zinco da corrosão na presença de outros metais. A opção mais simples seria adicionar magnésio, que revestiria o zinco para que, uma vez oxidado, os elétrons liberados do magnésio reduzissem os cátions de Zn.dois+ de volta.
No entanto, o filme de MgO no zinco acabaria rachando mais cedo ou mais tarde, fornecendo locais de ânodo de alta densidade de corrente; ou seja, a corrosão do zinco aceleraria fortemente exatamente nesses pontos.
Esta técnica de proteção contra corrosão eletroquímica é conhecida como o uso de revestimentos sacrificais. O mais conhecido é o zinco, usado na famosa técnica chamada galvanização. Neles, o metal M, principalmente o ferro, é revestido com zinco (Fe / Zn).
Mais uma vez, o zinco se oxida e seu óxido serve para cobrir o ferro e transmitir elétrons a ele que reduzem o Fe.dois+ que pode ser formado.
Revestimentos nobres
Suponha novamente que você deseja proteger a mesma folha de zinco, mas agora usará cromo em vez de magnésio. O cromo é mais nobre (mais catódico, ver tabela de índices anódicos) do que o zinco e, portanto, funciona como um revestimento nobre.
O problema com esse tipo de revestimento é que, uma vez que ele trinca, ele promove e acelera ainda mais a oxidação do metal por baixo; neste caso, o zinco corroeria ainda mais do que ser revestido com magnésio.
E, finalmente, existem outros revestimentos que consistem em tintas, plásticos, antioxidantes, gorduras, resinas, etc..
Experiência para crianças
Placa de ferro na dissolução de sais de cobre
Um experimento simples pode ser planejado a partir da mesma tabela de índices anódicos. Dissolvendo uma quantidade razoável (menos de 10 gramas) de CuSO45hdoisOu na água, uma criança é convidada a mergulhar em uma placa de ferro polido. Uma foto é tirada e o processo pode se desenrolar por algumas semanas.
A solução é inicialmente azulada, mas começará a desbotar enquanto a placa de ferro fica com uma cor acobreada. Isso ocorre porque o cobre é mais nobre que o ferro e, portanto, seus cátions Cudois+ Eles serão reduzidos a cobre metálico a partir dos íons dados pela oxidação do ferro:
Fé => Fédois+ + 2e-
Cudois+ + 2e- => Cu
Limpeza de óxido de prata
Objetos de prata escurecem com o tempo, especialmente se estiverem em contato com uma fonte de compostos de enxofre. Sua ferrugem pode ser removida mergulhando o objeto em uma banheira com bicarbonato de sódio e papel alumínio. O bicarbonato fornece os eletrólitos que irão facilitar o transporte de elétrons entre o objeto e o alumínio.
Como resultado, a criança perceberá que o objeto perde suas manchas pretas e brilhará com sua cor prateada característica; enquanto a folha de alumínio irá corroer para desaparecer.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Wikipedia. (2019). Corrosão galvânica. Recuperado de: en.wikipedia.org
- Stephen Lower. (16 de junho de 2019). Corrosão Eletroquímica. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- A Universidade Aberta. (2018). 2.4 Processos de corrosão: corrosão galvânica. Recuperado de: open.edu
- Escova de serviço técnico ao cliente Wellman Inc. (s.f.). A Guide to Galvanic Corrosion. Brush Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experimentos em eletroquímica. Recuperado de: funsci.com



Ainda sem comentários